
erektion — ejakulation — penis — hoden — endokrinologie — fertilität — genetische aspekte — aging male — varia

Licht in die „Black Box“ der männlichen Sexualfunktionen?
Über die Steuerung der Ejakulation ist bislang erheblich weniger bekannt als über die der Erektion. Demzufolge sind Behandlungsstrategien
bei Erektionsstörungen das „Stiefkind“ in der Therapie der Sexualstörungen beim Mann. Im Vordergrund steht hierbei die Ejaculatio praecox mit
erheblichen negativen Auswirkungen auf das Sexualleben der Betroffenen und der Partnerinnen. Doch bereits bei der Definition der Ejaculatio
praecox scheiden sich die Geister. Während die einen auf einer objektiven Zeitmessung beharren, orientieren sich andere unter praktischen
Gesichtspunkten eher am subjektiven Empfinden und am Leidensdruck des Patienten. In den letzten Jahren wurde die Rolle des Serotonins bei
der inhibitorischen Kontrolle des Ejakulationsreflexes eingehend untersucht. Hieraus resultierten Therapieversuche mit selektiven
Serotonin-
Neurophysiologie der Ejakulation
-
An der Ejakulation sind glanduläre (Prostata, Samenbläschen) wie auch muskuläre (Vas deferens, Blasenhals, Musculus bulbospongiosus)
Strukturen beteiligt und werden über ein komplexes Zusammenspiel des sympathischen, parasympathischen und somatischen Nervensystems
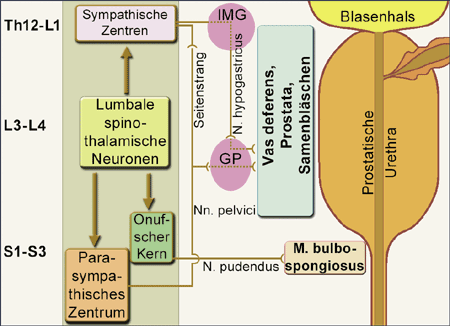
gesteuert. Deren jeweilige Zentren im Rückenmark liegen im thorakolumbalen Bereich, im Sakralmark bzw. im Onufschen Kern (Abb. 1).
In ihnen werden zentrale und periphere, sensorische Signale verarbeitet und als sekretorische und motorische Impulse an die pelvinoperinealen
anatomischen Korrelate der Ejakulation ausgegeben. Eine herausragende Rolle spielen hierbei die so genannten lumbalen spinothalamischen
Zellen (L3-L4). Sie senden Projektionen zu den sympathischen und parasympathischen präganglionären Neuronen, die insbesondere die Prostata
und die Samenbläschen innervieren sowie Projektionen zu den Motoneuronen des Musculus bulbospongiosus. Darüber hinaus projizieren die
lumbalen spinothalamischen Zellen zum Nucleus subparafascicularis des Thalamus [1].
|
Abb. 1: Schematische Darstellung der sympathischen, parasympathischen und somatischen Zentren für den Ejakulationsreflex im Rückenmark,
wie sie am Rattenmodell identifiziert worden sind: Die lumbalen spinothalamischen Neuronen (L3-L4) fungieren als spinales Koordinationszentrum
für die peripheren ejakulationsauslösenden Prozesse. Bei Ratten kann durch elektrische Mikrostimulation dieser Neuronen die Ejakulation mit
der Expulsion motiler Spermien ausgelöst werden. Aufgrund der vergleichbaren Organisation des Rückenmarks bei Mensch und Ratte kommt diesen
Befunden auch Bedeutung in der Reproduktionsmedizin zu. IMG = Intermesenterisches Ganglion; GP = Ganglion pelvinum (mod. nach Borgdorff AJ, et al. 2008). |
Anhand von Positronen-Emissions-Tomographie (PET)-Studien wurden Gehirnareale identifiziert, die mutmaßlich an der Kontrolle der Ejakulation beteiligt sind [2]. Bei diesem bildgebenden Verfahren werden Erhöhungen des regionalen zerebralen Blutflusses sichtbar gemacht und daraus auf gesteigerte Aktivität geschlossen.
Die am stärksten ausgeprägten Aktivitäten wurden in Strukturen der Übergangszone von Mesenzephalon und Dienzephalon einschließlich des ventralen Tegmentums registriert. Deutliche Aktivitäten zeigten sich auch in Arealen des Striatum und des Cortex cerebri. Jedoch fand sich bei Männern – anders als in Rattenversuchen – kein erhöhter Blutfluss in der Area praeoptica mediana.
Interessanterweise wurden während der Ejakulation auch weite Anteile des Kleinhirns aktiviert. Da zerebellare Strukturen bekannterweise bei Emotionen eine Rolle spielen, schließen die Autoren, dass nicht nur Bewegungen des Probanden zu den Reaktionen des Kleinhirns im Zusammenhang mit der Ejakulation geführt haben.
Insgesamt zeigt das zerebrale Erregungsmuster bei der Ejakulation (Orgasmus) eine ähnliche Verteilung wie sie auch bei anderen „Belohnungen“ beobachtet wird. Analogien zu Berichten über zerebrale/zerebellare Aktivierung während eines „Heroin Rush“, sexueller Erregung, dem Lauschen erbaulicher Musik oder dem Empfang eines unerwarteten Geldsegens sind auffällig.
Deaktivierung während der Ejakulation findet in Teilen der Amygdala und dem entorhinen Kortex statt. Über ein breites Spektrum von Spezies hinweg, lässt sich eine Aktivierung der Amygdala bei Angst machenden Stimuli nachweisen.
Obwohl die urogenitalen Funktionen bei Männern mit Rückenmarkverletzungen deutlich beeinträchtigt sind, ist seit geraumer Zeit bekannt, dass Männer mit kompletter Durchtrennung des thorakalen Rückenmarks vielfach in der Lage sind, aufgrund peripherer Stimulation zu ejakulieren.
In einer aktuell veröffentlichten tierexperimentellen Untersuchung von Borgdorff et al. (2008) wurden die spinothalamischen Neuronen im
Lendenwirbelbereich (L4) als wesentliches anatomisches Äquivalent für die Regulation der Ejakulation identifiziert. Bei anästhesierten
Rattenmännchen führte eine kurze elektrische Mikrostimulation im Bereich dieser Zellen zum Ausstoß von Samen mit zum Teil motilen Spermien [3].
Diese Ergebnisse können dazu beitragen, Männern mit einer Rückenmarkverletzung zu physiologischeren Ejakulationen, befriedigenderem
Geschlechtsverkehr und natürlicherer Zeugung von Kindern zu verhelfen [4].
-
Bei der Definition des vorzeitigen bzw. zu frühen Samenergusses (Ejaculatio praecox) bestehen Kontroversen zwischen Befürwortern
einer objektiven Messmethode und jenen, die sich eher an der Belastung für Betroffene und/oder der Partnerinnen orientieren. Erste
verwenden die von Waldinger und Kollegen eingeführte, mit der Stoppuhr gemessene IELT (Intravaginal Ejaculatory Latency Time). Diese
wird zumeist in klinischen Studien herangezogen, um Behandlungsstrategien für Ejaculatio praecox bewerten zu können.
Für die Belange der Praxis eignet sich die IELT kaum. Zudem wurde von Rosen et al. (2007) ermittelt, dass geschätzte und gemessene IELT für die Diagnose der Ejaculatio praecox austauschbar sind [7]. Weniger die objektive Zeit als vielmehr das subjektive Empfinden des Patienten ist dafür entscheidend, ob ein Behandlungsbedarf besteht. In der von MacMahon CG, et al. (2004) publizierten Definition der Ejaculatio praecox liegt die Betonung auf dem Leidensdruck, der bei mangelnder willentlicher Kontrolle des Ejakulationsprozesses entsteht [5].
In der Praxis haben sich validierte Fragebögen, anhand derer sich die Fähigkeit zur Ejakulationskontrolle und das Ausmaß des Leidensdrucks bei beiden Partnern – so genannte Patient Reported Outcomes (PROs) – ermitteln lassen, weitgehend bewährt. Mit wenigen dieser PROs lässt sich ein Profil der Ejaculatio praecox erstellen (Premature Ejaculation Profile; PEP), anhand dessen unabhängig von der IELT zwischen Männern mit und ohne vorzeitigem Samenerguss unterschieden werden kann.
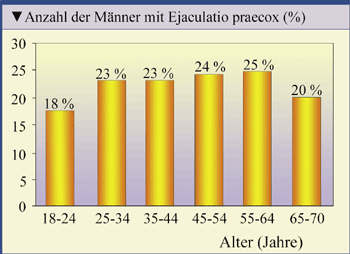
Ejaculatio praecox gilt als die häufigste Sexualstörung des Mannes. Angaben zur Prävalenz gehen allerdings weit auseinander – von 9% bis hin zu 31% [1]. In einer neueren Erhebung in Deutschland, Italien und den Vereinigten Staaten – der Premature Ejaculation Prevalence and Attitudes (PEPA)-Survey – wurden keine wesentlichen nationalen Unterschiede registriert [6]. Es zeigte sich, dass die Prävalenz der Ejaculatio praecox bei Männern über 24 Jahre weitgehend altersunabhängig ist (Abb. 2).
|
Abb. 2: Prävalenz der Ejaculatio praecox nach Altersgruppen: Ergebnisse der Premature Ejaculation Prevalence and Attitudes (PEPA) Survey, einer Internet-basierten Umfrage in Deutschland, Italien und den USA (Porst H, et al. 2007). |
In einer fünf europäische Länder umfassenden Beobachtungsstudie wurde anhand von Bewertungen der rekrutierten Männer und ihrer Partnerinnen ein Profil der frühzeitigen Ejakulation (PEP; Premature Ejaculation Profile) erstellt. Das PEP beinhaltete eine Beurteilung der Kontrolle über die Ejakulation, den Leidensdruck, die Zufriedenheit mit dem Geschlechtsverkehr, und Schwierigkeiten zwischen den Partnern. Aufgrund ihrer Scores wurde bei etwa 18% der Teilnehmer eine Ejaculatio praecox diagnostiziert. Diese Männer hatten im Durchschnitt eine mit der Stoppuhr gemessene IELT von 3,3 Minuten – gegenüber 10,0 Minuten bei den Studienteilnehmern ohne Ejaculatio praecox. Diesbezüglich bestand allerdings eine nicht unerhebliche Überlappung zwischen den Gruppen [8]. Aus diesen Befunden wird insbesondere deutlich, dass die Diagnose Ejaculatio praecox sehr unterschiedlich ausfallen kann, je nach dem sich der Arzt an der IELT oder PROs orientiert. Diese Daten decken sich weitgehend mit jenen, die zuvor in einer ähnlich konzipierten US-amerikanischen Studie ermittelt worden waren [9].
-
Dem Serotonin (5-Hydroxytryptamin; 5-HT) kommt die maßgebliche Rolle bei der inhibitorischen Kontrolle des Ejakulationsreflexes zu [1].
Seine Freisetzung wird über verschiedene Mechanismen durch die serotoninergen Neuronen selbst reguliert. Aktivierte somatodendritische
Serotonin-
Durch Blockade der 5-HT-Transporter mit selektiven Serotonin-Wiederaufnahmehemmern (SSRI) lässt sich anhaltend eine Erhöhung des 5-HT-Spiegels in den Synapsen und um die Zellkörper im serotoninergen System erzielen. Seit den frühen 1990er Jahren wurden zahlreiche klinische Prüfungen mit SSRI (Fluoxetin, Sertralin, Paroxetin) durchgeführt, in denen insgesamt die Wirksamkeit dieser Substanzgruppe in der Behandlung bei Ejaculatio praecox nachgewiesen worden ist. Bei chronischer Anwendung erreichten bis zu 85% der Patienten binnen weniger Wochen eine etwa sechs- bis achtfache Verlängerung ihrer Latenzzeit bis zur Ejakulation. Allerdings sind bei längerfristiger Einnahme von SSRI eine Reihe von Nebenwirkungen wie Mundtrockenheit, Übelkeit, Schläfrigkeit und verminderte Libido zu gewärtigen. Zudem können SSRI andere Sexualstörungen wir Anejakulation verursachen.
Inwieweit auch bei einer Einnahme von SSRI bei Bedarf eine Besserung bei Ejaculatio praecox erreicht wird, ist aufgrund der stark diskrepanten
Studienergebnisse nicht klar. Auch mit Dapoxetin, einem SSRI mit kurzer Halbwertzeit wurden statistisch signifikant verlängerte Latenzzeiten
erreicht. Die Wirksamkeit der Substanz begann mit der ersten Einnahme. Allerdings wurde maximal eine Verlängerung der IELT auf das knapp
Vierfache erzielt.
-
Im Alter nimmt die Empfindlichkeit gegenüber taktilen sexuellen Reizen physiologischerweise ab. Daher benötigen ältere Männer zur
Ejakulationsauslösung eine höhere Reizintensität. Beim Geschlechtsverkehr mit einer Frau, die mehrere Kinder geboren hat, reicht der den
Penis stimulierende Kontakt mit der Vaginalwand unter Umständen nicht aus, um den Ejakulationsreflex auszulösen, bevor es zur Erschlaffung
bzw. zur Erschöpfung kommt.
Die Ejakulation kann auch bei Männern mit einem schwergradigen Hypogonadismus oder einer Hyperprolaktinämie verzögert sein. Verschiedentlich
wurde über Medikamenten-bedingte Verzögerungen der Ejakulation berichtet. Diesbezüglich sind Alpha-Blocker und Psychopharmaka zu nennen.
-
Schmerzhafte Erektionen können sowohl durch chronische als auch durch akute Prostatitiden sowie durch Symptome des unteren Harntraktes
(LUTS) infolge einer benignen Prostatahyperplasie (BPH) verursacht werden. Typischerweise verspüren die Patienten bei der Ejakulation
ein Stechen oder Reißen. Durch eine Behandlung mit Alpha-Blockern kann betroffenen Männern in den meisten Fällen geholfen werden.
-
Bei der retrograden Ejakulation gelangt die Samenflüssigkeit in die Harnblase, anstatt durch die Harnröhre ausgestoßen zu werden. Das ist
eine Folge der Schwächung oder Zerstörung des inneren Harnblasenschließmuskels. Dieser ist weniger stark als der unmittelbar unterhalb der
Prostata lokalisierte äußere Schließmuskel und trägt auch in geringerem Maße zur Harnkontinenz bei.
Als Ursache für retrograde Ejakulation kommen in erster Linie chirurgische Eingriffe wie die Prostataresektion, Verletzungen im Bereich des Damms oder Rektums und Rückenmarkerkrankungen/-verletzungen in Betracht. Ferner können ein Diabetes mellitus und Alkoholabusus über die Auslösung von Neuropathien ursächlich sein. In seltenen Fällen führt die Einnahme von Alpha-Blockern zu retrograder Ejakulation oder es besteht eine Entzündung der ableitenden Samenwege.
Die retrograde Ejakulation gilt als harmlos. Allerdings kommt es zu Infertilität. Bei Kinderwunsch kann die Aufbereitung des Samens aus dem nach einer Ejakulation gewonnenen Urins zur In-vitro-Fertilisation herangezogen werden.
Zur Klärung der Häufigkeit und Art von Ejakulationsstörungen bei Männern unter der Einnahme von Alpha-Blockern unternahmen Hellstrom und Sikka (2006) Untersuchungen an jungen, gesunden Männern ohne Erektionsprobleme und ohne Prostatabeschwerden. Die Probanden erhielten randomisiert fünf Tage lang entweder 0,8 mg Tamsulosin, 10 mg Alfuzosin oder ein entsprechendes Plazebo. In der Tamsulosin-Gruppe wurde im Gegensatz zu der Alfuzosin- und der Plazebo-Gruppe ein deutlich reduziertes Ejakulatvolumen registriert. Dies betraf etwa 90% der Probanden, von denen sogar 35% Anejakulationen hatten [10].
Bemerkenwert bei der Studie von Hellstrom und Sikka (2006) war, dass die Suche nach Spermien im postejakulatorischen Urin keine signifikanten Unterschiede zwischen den drei Gruppen lieferte. Das widerspricht der Annahme, dass Alpha-Blocker wie insbesondere Tamsulosin durch einen relaxierenden Effekt an der glatten Muskulatur des Blasenhalses deren Schließfähigkeit herabsetzt und so retrograde Ejakulationen begünstigt. Allerdings ließe sich damit der hohe Anteil an Männern mit Ejakulationsstörungen, die Tamsulosin einnehmen, gegenüber jenen, die einen anderen Alpha-Blocker anwenden (<1%), auch nicht erklären. Das Bindungsprofil verschiedener Alpha-Blocker an alpha1-adrenerge Rezeptoren ist weitgehend identisch, so dass durch Alpha-Blocker hervorgerufene Ejakulationsstörungen offenbar auf periphere oder zentrale nervale Mechanismen zurückzuführen sind.
Hisasue S, et al. (2006) kamen bei einer Untersuchung von Ejakulations störungen insbesondere unter Tamsulosin-Einnahme zu dem Ergebnis, dass
offenbar eine verminderte Kontraktilität der Samenbläschen zu einem signifikant verringerten Ejakulatvolumen führen kann [11].
-
Männer, die sich der Behandlung eines lokalisierten Prostatakarzinoms unterziehen, müssen danach mit Ejakulationsstörungen in der einen oder
anderen Form rechnen. Typisch sind reduzierte Ejakulatvolumina nach radikaler Prostatektomie oder schmerzhafte Ejakulationen nach einer Strahlentherapie.
Doch schon vor einer diesbezüglichen Therapie liegt bei der Hälfte der Patienten bereits ein vermindertes Ejakulatvolumen vor. Waltz J, et al. (2007)
ermittelten in einer Kohorte von 1 273 Studienteilnehmern anhand von Fragebögen die Rate an Männern mit vermindertem Ejakulatvolumen, schmerzhaften
Ejakulationen und zugleich vorliegender erektiler Dysfunktion. Von den im Durchschnitt 58-jährigen Männern hatten 46% ein vermindertes Ejakulatvolumen
und 11% klagten über schmerzhafte Ejakulationen. Beide Störungen führten bei einem Großteil der Männer zu erheblicher Besorgnis [12].
Literatur:
[1] Giuliano F, Clément P, 2006. Serotonin and premature ejaculation: from physiology to patient management. Eur Urol 50:454-466.
[2] Holstege G, Georgiadis JR, Paans AMJ, et al. 2003. Brain activation during human male ejaculation. J Neurosci 23:9185-9193.
[3] Borgdorff AJ, Bernabé J, Denys P, et al. 2008. Ejaculation elicited by microstimulation of lumbar spinothalamic neurons. Eur Urol doi:10.1016/j.eururo.2008.03043
[4] Shindel AW, Lue TF 2008. Coming around to a new understanding of the neurophysiology of ejaculation. Eur Urol doi:10.1016/j.eururo.2008.03045
[5] McMahon CG, Abdo C, Incrocci L, et al. 2004. Disorders of orgasm and ejaculation in men. J Sex Med 1:58-65.
[6] Porst H, Montorsi E, Rosen RC, et al. 2007. The Premature Ejaculation Prevalence and Attitudes (PEPA) survey: Prvalence, comorbidities, and professional help-seeking. Eur Urol 51:816-824.
[7] Rosen RC, McMahon CG, Niederberger C, et al. 2004. Correlates to the clinical diagnosis of premature ejaculation: results from a large observational study of men and their partners. J Urol 177:1059-1064.
[8] Giuliano F, Patrick DL, Porst H, et al. for the 3004 Study Group 2008. Premature ejaculation: results ftom a five-country European observational study. Eur Urol 53:1048-1057.
[9] Patrick DL, Althof SE, Pryor JL, et al. 2005. Premature ejaculation: an observational study of men and their partners. J Sex Med 2:358-367.
[10] Hellstrom WJG, Sikka SC, 2006. Effects of acute treatment with tamsulosin versus alfuzosin on ejaculatory function in normal volunteers. J Urol 176:1529-1533.
[11] Hisasue S, Furuya R, Itoh H, et al. 2006. Ejaculatory disorder caused by alpha-1 adrenoceptor antagonists is not retrograde ejaculation but a loss of seminal emission. Int J Urol 13:1311-1316.
[12] Walz J, Perrotte P, Gallina A, et al. 2007. Ejaculatory disorders may affect screening for prostate cancer. J Urol 178:232-238.
© 2003-2026 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
