

„Antennen“ für Acetylcholin im gesamten Organismus auf Empfang
Acetylcholin fungiert im Zentralnervensystem (ZNS) und im vegetativen peripheren Nervensystem
als synaptischer Überträgerstoff. Seine Wirkungen kommen entweder über nikotinerge oder muskarinerge
Acetylcholinrezeptoren zustande. Letztere gewinnen als Zielmoleküle für medikamentöse Therapien
zunehmend an Bedeutung. Muskarinrezeptor-Antagonisten (sogenannte Antimuskarinika) haben sich
als einzige effektive medikamentöse Behandlungsoption bei überaktiver Blase (OAB) und Dranginkontinenz
durchgesetzt. Ihre Anwendung wird allerdings häufig durch Nebenwirkungen begrenzt. Diesbezüglich ist
die Verbreitung von Muskarinrezeptor-Subtypen und die Rezeptorkinetik verschiedener Antimuskarinika
von Interesse.
Muskarinrezeptoren sind Acetylcholinrezeptoren, die sich durch das Pilzgift Muskarin aktivieren lassen
-
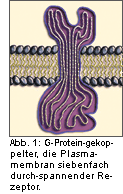
Die Familie der muskarinergen Acetylcholinrezeptoren umfaßt fünf Subtypen, M1– M5, die alle von einem
separaten Gen kodiert werden. Das Rezeptorprotein durchspannt die Zellmembran von Nervenzellen jeweils
siebenfach (Abb. 1). Es handelt sich um ein G-Protein-bindendes Molekül, bei dessen Aktivierung eine
intrazelluläre Signalkaskade in Gang gesetzt wird. Je nachdem, mit welchem G-Protein ein Muskarinrezeptor
interagiert, werden verschiedene Reaktionswege über unterschiedliche sekundäre Botenstoffe beschritten.
-
Wichtigster Muskarinrezeptor-Subtyp im Gehirn ist M1. Er dominiert anteilsmäßig mit ca. 36% gegenüber 21% M2-
und 25% M3-Rezeptoren. Durch Aktivierung oder Deaktivierung des M1-Rezeptors im frontalen Kortex und im
Hippokampus werden kognitive Funktionen wie Orientierungs-, Konzentrations- und Merkfähigkeit beeinflußt.
Deshalb kann eine Schwächung der Acetylcholin-Stimuli insbesondere bei älteren Menschen – sei es durch den
Verlust an M1-Rezeptoren im Alter, oder durch eine Behandlung mit Antimuskarinika, die über die
Blut-
Über cholinerge und anticholinerge Substanzen in Verbindung mit M1-Rezeptoren wirken auch halluzinogene
Drogen wie Arecolin (Betel-Nuß) bzw. Atropin (Stechapfel, Tollkirsche).
-
Die Kontraktion des Detrusors wird durch Aktivierung des vesikulären M3-Rezeptors ausgelöst [1].
Hierbei kommt es offenbar nicht zu der bislang vielfach angenommenen Kontraktionsauslösung durch vermehrte
Freisetzung des sekundären Botenstoffs Inositoltriphosphat (IP3) und die von ihm induzierte Erhöhung der
intrazellulären Ca2+-Konzentration. Vielmehr spielen die Inhibition von Kaliumkanälen und die rho-Kinase
eine Rolle. Letztere bewirkt unter anderem eine vermehrte Phosphorylierung des Myosinmoleküls und induziert
hierdurch die Muskelkontraktion [2].
In der Harnblase übertrifft der M2- den M3-Rezeptor zahlenmäßig um ein Mehrfaches. Das spricht für eine wichtige Rolle im Rahmen der Kontrolle von Harnspeicherung und Harnentleerung. Nach gängiger Auffassung wird die über 3-Rezeptoren sympathisch gesteuerte Detrusorrelaxation während der Speicherphase durch die Aktivität von M2-Rezeptoren während der Entleerungsphase außer Kraft gesetzt. Aufgrund der Bedeutung der M2-Rezeptoren für die Harnblasenfunktion ist eine selektive M3-Blockade bei OAB wahrscheinlich nicht zielführend.
Bei In-vitro-Experimenten mit Harnblasengewebe von Knock-out-Mäusen, denen entweder das Gen für den M2- oder den M3-Rezeptor stummgeschaltet worden war, erwies sich die kontraktionsvermittelnde Rolle der M2-Rezeptoren als weniger ausgeprägt als die der M3-Rezeptoren. Sind beide Rezeptoren zugleich ausgeschaltet, werden acetylcholinerge Signale nicht mehr verarbeitet. Andererseits war die Blasenfunktion bei diesen Doppelt-Knock-out-Mäusen im lebenden Tier nicht gestört. Bei Ausschaltung der muskarinergen Rezeptoren werden offenbar nichtcholinerge Mechanismen hochreguliert [3].
Zur parasympathisch gesteuerten Blasenentleerung trägt nicht nur die efferente Innervation der glatten
Detrusormuskulatur, sondern auch die afferente sensorische Innervation in der vesikalen Schleimhaut bei.
Letztere hat nach neueren Erkenntnissen eine muskarinerge Komponente. Denn bei Instillation von
Antimuskarinika in die Harnblase von Ratten, läßt sich eine Carbachol-induzierte Kontraktion des
Detrusors unterdrücken [4]. Dieser topische Effekt ist möglicherweise von pharmakologischem Nutzen:
Die Carbachol-induzierte Kontraktion des Detrusors bei Ratten läßt sich auch unterdrücken, wenn ihnen
der Urin von Menschen in die Blase instilliert wurde, die Trospiumchlorid eingenommen hatten. Wurden
hingegen von den Urinspendern Tolterodin oder Oxybutynin ebenfalls in vorgeschriebener Dosierung
eingenommen, wurde bei den damit behandelten Ratten durch Carbachol eine Detrusorkontraktion ausgelöst [5].
-
Sämtliche Regionen des menschlichen Herzens werden über den Plexus cardiacus vom Nervus vagus innerviert.
Die Muskarinrezeptoren des Herzens sind zu ca. 90% vom Typ M2. Ihre parasympathische Wirkung in den Vorhöfen (Bradykardie) kommt über inhibitorische G-Proteine zustande. In den Kammern vermitteln die M2-Rezeptoren negativ inotrope Effekte.
In den Koronargefäßen wurden M3-Rezeptoren nachgewiesen. Diese sollen nach Ergebnissen aus Tierversuchen
in erster Linie eine Relaxation der Koronargefäße bewirken [6]. Jüngsten Erkenntnissen zufolge werden den
M3-Rezeptoren am Herzen zytoprotektive Wirkungen beigemessen. Acetylcholin-Einflüsse sollen vor ischämischen
myokardialen Schäden schützen [7].
-
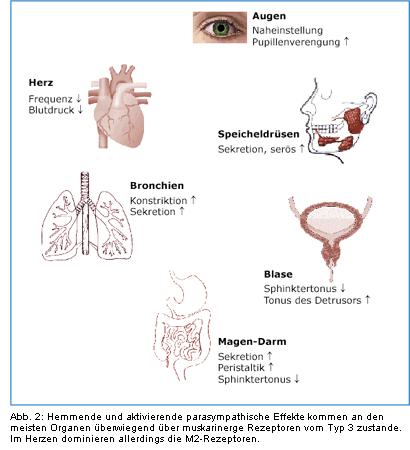
Parasympathische hemmende oder aktivierende Einflüsse werden in zahlreichen Organen überwiegend durch den
M3-Rezeptor vermittelt (Abb. 2). Diese Rezeptoren sind in erster Linie auf glatten Muskelzellen und in
Drüsen lokalisiert. Sie induzieren Muskelkontraktionen und eine erhöhte Sekretion.
Speicheldrüsen: In der rein serösen Ohrspeicheldrüse (Parotis) kommen ausschließlich M3-Rezeptoren vor. Hingegen erfolgt die Steuerung des Speichelflusses in der Glandula sublingualis und der Gl. submandibularis auch über M2-Rezeptoren [8].
Schweißdrüsen: Außer M1-Rezeptoren sind in den Schweißdrüsen alle anderen Subtypen nachgewiesen worden. Die Regulierung Schweißproduktion ist aber eindeutig von M3-Rezeptoren abhängig.
Pankreas: Parasympathische Effekte am exokrinen Pankreas werden über M1- und M3-Rezeptoren vermittelt [9]. Letztere steuern zusammen mit M1-Rezeptoren auch die endokrine Funktion der -Zellen in den Langerhansschen Inseln [10].
Auge: Der für die ophtalmologischen Nebenwirkungen verantwortliche Rezeptortyp ist der M3-Rezeptor. Er löst neben dem Kammerwasserflow die Akkomodation und Miosis des Ziliar-muskels bzw. der Linse aus.
-
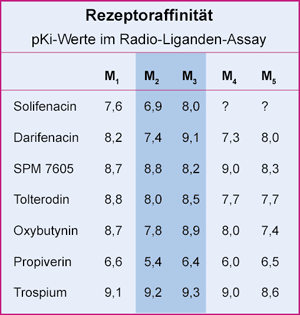
Als Maß für die Rezeptoraffinität dient der pKi-Wert. Dieser ist wie der pH-Wert ein negativer dekadischer
Logarithmus, so daß ein um eins höherer Wert eine 10fach niedere Konzentration ausdrückt. Mit einem pKi
von 9,3 besitzt Trospiumchlorid gegenüber dem M3-Rezeptor die größte Affinität aller für die Indikation
überaktive Blase zugelassenen Antimuskarinika (Abb. 3). Demzufolge wird mit dieser Substanz bei der
vergleichsweise niedrigsten Konzentration die halbmaximale Wirkung erzielt.
Mit einer hohen Rezeptorselektivität pharmakologischer Substanzen lassen sich vielfach Nebenwirkungen reduzieren.
Dies ist durch eine M3-Selektivität der Antimuskarinika zur Behandlung der überaktiven Blase nur bedingt möglich.
Bei einem Unterschied der pKi-Werte von M3 zu M1 von 1,7 im Fall von Darifenacin ist unter Umständen davon
auszugehen, daß sich zentralnervöse Wirkungen reduzieren. In der Mehrheit der Organe sind aber M3-Rezeptoren – wie
in der Harnblase – an der Regulierung der Funktion maßgeblich beteiligt.
In Anlehnung an den Vortrag „Medikamentöse
Therapie der OAB: »Good News oder
Never Ending Story?« von Dr. med. Andreas
Wiedemann (Gelsen kirchen) anläßlich der 9.
Bamberger Gespräche „Der ältere Patient
mit Blasen funktionsstörungen – Sinnvolle
Diagnostik und Therapie in der Praxis“ am
10. September 2005 in Bamberg.
[1]Fetscher C, Fleichman M, Schmidt M, et al. 2002. M3 muscarinic receptors mediate contraction of human urinary bladder. Br J Pharmacol 136:641-643.
[2]Schneider T, Fetscher C, Krega S, Michel MC. 2004. Signal transduction underlying carbachol-induced contraction of human urinary bladder. J Pharmacol Exp Ther 309:1148-1153.
[3]Kumar V, Cross RL, Chess-Williams R, Chapple CR. 2005. Recent advances in basic science for overactive bladder. Curr Opin Urol 15:222-226.
[4]Kim Y, Yoshimura N, Masuda H, et al. 2005. Antimuscarinic agents exhibit local inhibitory effects on muscarinic receptors in bladderafferent pathways. Urology 65:238-242.
[5]Kim Y, Yoshimura N, Masuda H, et al. 2006. Intravesical instillation of human urine after oral administration of trospium, tolterodine and oxybutynin in a rat model of detrosor overactivity. BJU Int 97:400-403.
[6]Lamping KG, Wess J, Cui Y, et al. 2004. Muscarinic (M) receptors in coronary circulation: gene-targeted mice define the role of M2 and M3 receptors in response to acetylcholine. Arterioscler Thromb Vasc Biol 24:1253-1258.
[7]Yang B, Lin H, Xu C, et al. 2005. Choline produces cytoprotective effects agains ischemic myocardial injuries: evidence for the role of cardiac m3 subtype muscarinic acetylcholine receptors. Cell Physiol Biochem 16:163-174.
[8]Melvin JE, Yule D, Shuttleworth T, Begenisich T. 2005. Regulation of fluid and electrolyte secretion in salivary gland acinar cells. Annu Rev Physiol 67:445-469.
[9]Niebergall-Roth E, Singer MV. 2003. Control of pancreatic exocrine secretion via muscarinic receptors: which subtype(s) are involved? A review. Pancreatology 3:284-292.
[10]Iismaa TP, Kerr EA, Wilson JR. 2000. Quantitative and functional characterization of muscarinic receptor subtypes in insulin-secreting cell lines and rat pancreatic islets. Diabetes 49:392-398.
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
