

Lässt sich mit PSA-Screening die Mortalitätsrate beim Prostatakrebs senken?
Im Frühjahr dieses Jahres erschienen im New England Journal of Medicine zwei Arbeiten, in denen zum einen die vorläufigen Ergebnisse
der European Randomized Study of Screening for Prostate Cancer (ERSPC) [1] und zum anderen die einstweiligen Ergebnisse der Prostate,
Lung, Colorectal, and Ovarian (PLCO) Cancer Screening Trial [2] hinsichtlich des Einflusses von Screening-Programmen auf die
Prostatakrebs-
-
Die kontroverse Diskussion um die Nutzen-/Schadensbilanz der PSA-Testung zur Früherkennung von Prostatakrebs sollte mit dem Bekanntwerden der Ergebnisse
aus den großen Screening-Studien in Europa und den USA eigentlich abklingen. Doch im Gegenteil, Befürworter und Gegner des Prostatakrebs-
Dass mit dem PSA-Test bzw. einem umfassenden Screening mehr Prostatakarzinome früher entdeckt werden können, scheint unstrittig. Die wesentliche Frage
ist indes, ob dadurch hinreichend Prostatakrebs-bedingte Todesfälle verhindert werden können, um das dazu erforderliche Maß an Überbehandlungen rechtfertigen
zu können.
-
Initiiert wurde die ERSPC bereits in den 1990er Jahren. Das Screening endete dann am 31.12.2006. Beteiligt waren die Niederlande, Belgien, Schweden,
Finnland, Italien, Spanien und die Schweiz.
Mit insgesamt 182.000 teilnehmenden Männern im Alter von 50 bis 74 Jahren (162.243 davon im voraus festgelegten Kernalter von 55 bis 69 Jahren) und einer
mittleren Beobachtungszeit von 8,8 Jahren (median 9 Jahre) liefert die ERSPC sicher eine gewichtige Datenquelle zur Nutzen-Risiko-
Bei den Teilnehmern der ERSPC-Screening-Gruppe (n = 82.816) war alle vier Jahre ein PSA-Test vorgesehen. Ausnahmen bildet Schweden mit zweijährlichen Abständen
und Belgien, wo sich der zweite Testdurchgang aus Finanzierungsschwierigkeiten um drei Jahre verzögerte. Im Mittel wurden 2,1 PSA-Tests pro Patient durchgeführt.
Bei 82% der Männer war es mindestens ein Test, was natürlich bedeutet, dass sich 18% der zum Screening vorgesehenen Männer überhaupt nicht daran beteiligt haben.
Das ist sicher nicht förderlich, um zu einem klaren Studienergebnis zu kommen. Andererseits wäre eine praktisch 100%ige Teilnahme am Screening überaus
realitätsfern.
In den meisten europäischen Zentren galten 3,0 ng/ml PSA als Indikation zur Biopsie. Allerdings gab es in einigen Ländern (zeitlich begrenzte) Abweichungen
in den Kriterien für die Indikation zur Biopsie. In den meisten Zentren wurden durch transrektalen Ultraschall geleitete Sextant-
Das Design der PLCO-Studie mit insgesamt 76.693 Teilnehmern im Alter von 55 bis 74 Jahren in zehn über die USA verstreuten Zentren unterschied sich vom ERSPC-Design
in einigen wesentlichen Punkten: Bei den 38.343 Männern, die randomisiert der Screening-Gruppe zugewiesen worden waren, sollte sechs Jahre hintereinander jährlich ein
PSA-Test durchgeführt werden. Zudem bestand das Angebot für jährliche digitale rektale Untersuchungen (DRU) auf vier Jahre. Die Teilnahme am PSA-Test belief sich auf
85% und die an der DRU auf 86%.
Für die Kontroll-Gruppe der PLCO-Studie war eine konventionelle Betreuung („usual care“) vorgesehen, die in den USA in sehr viel höherem Maße als
in Europa auch PSA-Tests vorsieht und den Kontrollprobanden daher nicht vorenthalten werden können. Von diesen nahmen denn auch 42% das Angebot im ersten
und sogar 52% im sechsten Studienjahr wahr. Die DRU-Rate reichte entsprechend von 40% bis 46%. Zudem hatte etwa jeder dritte Teilnehmer der PLCO-Studie
in beiden Studienarmen innerhalb der drei Jahre vor der Rekrutierung bereits mindestens eine Untersuchung einschließlich PSA-Test.
-
In der europäischen Studie wurde bei 8,2% der Männer in der Screening-Gruppe und bei 4,8% der Männer in der Kontroll-Gruppe ein Prostatakarzinom entdeckt.
Dieser Anteil variierte in den einzelnen Teilnehmerstaaten erheblich ̫ mit 3,9% als niedrigstem Anteil in der italienischen Screening-Gruppe bis 11,8% in
der schwedischen Screening-Gruppe. In den Kontroll-Gruppen waren es entsprechend 1,8% bzw. 7,1%.
Der Unterschied im Anteil entdeckter Prostatakarzinome zwischen Screening- und Kontroll-Gruppe war in der amerikanischen Studie deutlich weniger stark ausgeprägt
als in der europäischen (Abb. 1). Nach neun Jahren waren es in der Screening-Gruppe ca. 8,6% der Männer und in der Kontroll-Gruppe ca. 7,3%.
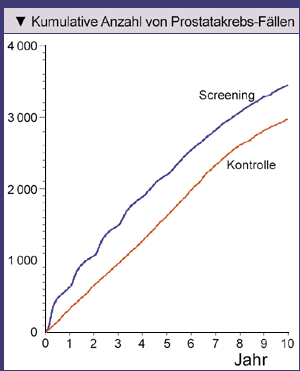
|
Abb. 1: Anzahl der Teilnehmer am Prostate, Lung, Colorectal, and Ovarian (PLCO) Cancer Screening Trial, bei denen eine Prostatakrebs- |
Obwohl ERSPC und PLCO wesentliche Unterschiede im Screening-Programm – insbesondere bezüglich der Testintervalle und des Schwellenwertes zur Biopsie-
-
In der ERSPC wurden in der Screening-Gruppe 261 und in der Kontroll-Gruppe 363 Prostatakrebs-
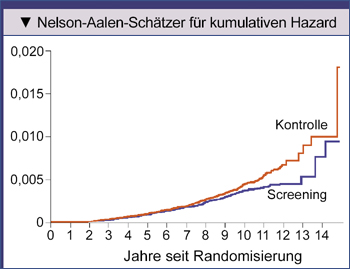
|
Abb. 2: Kumulatives Sterberisiko durch Prostatakrebs in der Prostate, Lung, Colorectal, and Ovarian (PLCO) Cancer Screening Trial: Die
korrigierte rate ratio für Prostatakrebs- |
Anhand der Intention-to-screen-Analyse machen die ERSPC-Autoren folgende Rechnung auf: Bei der keineswegs vollständigen Teilnahme des Studienkollektivs am PSA-Test müssten 1.410 Männer gescreent werden und 48 behandelt werden, um einen Prostatakrebs-bedingten Todesfall verhindern zu können. Andererseits meinen die Untersucher, dass die hohe Zahl unnötiger Behandlungen und die damit verbundene Vielzahl unerwünschter Nebeneffekte durch Vermeidung von Diagnose und Therapie indolenter Karzinome reduziert werden könnten.
Obwohl die Screening-Modalitäten in den einzelnen europäischen Zentren zum Teil variieren, waren die lokalen Ergebnisse mit dem Gesamtergebnis kompatibel.
Bei Ausschluss jeweils eines Zentrums liegen die rate ratios alle zwischen 0,74 und 0,84, so dass die Reduzierung der Prostatakrebs-spezifischen Mortalitätsrate
nicht einzelnen Ländern zugeschrieben werden kann. Zudem bestand kein signifikanter Unterschied bei der Gesamtmortalität.
-
Die Mortalitätsrate in der Screening-Gruppe bei PLCO liegt bei 0,20 Todesfällen pro 1.000 Personenjahre nach sieben Jahren und erhöhte sich
auf 0,27 Todesfälle pro 1.000 Personenjahre nach zehn Jahren (Auswertung zu 67% vollständig). Die entsprechenden Mortalitätsraten in der Kontroll-Gruppe
betragen 0,17 bzw. 0,24 Todesfälle pro 1.000 Personenjahre. Daraus ergeben sich rate ratios von 1,13 (95% CI 0,75-1,70) nach sieben Jahren und
von 1,11 (95% CI 0,83-1,50) nach zehn Jahren. Somit ist das Risiko, an Prostatakrebs zu sterben, im Kontroll-Arm – wenn auch statistisch nicht
signifikant – niedriger als im Screening-Arm (Abb. 3).
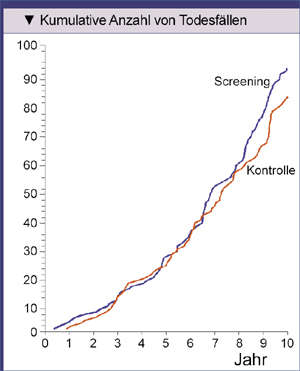
|
Abb. 3: Anzahl der Teilnehmer am Prostate, Lung, Colorectal, and Ovarian (PLCO) Cancer Screening Trial, die an Prostatakrebs verstorben sind (Andriole GL, et al. 2009). |
Bemerkenswerterweise lag die Mortalitätsrate im amerikanischen Studienkollektiv bei geringfügig höherer Prostatakrebs-Detektionsrate sowohl im Screening- als auch im Kontroll-Arm deutlich unter der im europäischen Studienkollektiv. Dieses Ergebnis kann mit aller Vorsicht dahingehend interpretiert werden, dass die offenbar diskrepanten Heilungsraten dem intensiveren Screening der Amerikaner zu verdanken sind, zumal davon auszugehen ist, dass die medizinische Versorgung von Prostatakrebs-
Andererseits ist bemerkenswert, dass die Todesfälle in beiden Gruppen kaum im Zusammenhang mit unterschiedlichen Tumorstadien standen. In der Screening-Gruppe
hatten 60% der verstorbenen Patienten ein Prostatakarzinom im Stadium I oder II, 2% im Stadium III und 36% im Stadium IV. Bei den Kontrollen waren es
entsprechend 52%, 4% bzw. 39%.
-
Im Kollektiv der PLCO-Studie war die Sterblichkeit an Prostatakrebs, die sich im weiteren Verlauf der Nachbeobachtung noch deutlich erhöhen wird, sowohl
im Screening als auch im Kontroll-Arm sehr gering. Dennoch räsonieren die Autoren der PLCO-Studie darüber, ob sie in der Screening-Gruppe gegenüber der
Kontrollgruppe eine niedrigere Mortalitätsrate hätten erreichen können, wenn der PSA-Schwellenwert für die Biopsie-Empfehlung anstatt bei 4,0 ng/ml wie
in der ERSPC bei 3,0 ng/ml gelegen hätte. Die Überlegungen führen aber dahin, dass damit wahrscheinlich in der Hauptsache mehr Prostatakarzinome mit
günstiger Prognose entdeckt worden wären und sich damit die Rate der Überdiagnosen erhöht hätte. Die erhöhte Sensitivität geht zudem auf Kosten einer
reduzierten Spezifität. Es ließe sich beim Vergleich mit den Daten der ERSPC auch argumentieren, dass in der PLCO-Studie der Benefit eines
Prostatakrebs-
Die europäische und amerikanische Screening-Studie unterscheiden sich in erster Linie bezüglich der Screening-Intervalle und der Definition der Kontroll-Gruppe. Bei PSA-Tests im Abstand von vier Jahren wird von einer Vorlaufzeit von fünf bis zehn Jahren ausgegangen. Es ist jedoch zu befürchten, dass die Vorlaufzeit bei aggressiven Karzinomen um Etliches kürzer ist. Daher sind solche Tumoren, die hinsichtlich der Senkung der Prostatakrebs-bedingten Mortalitätsrate das primäre Ziel des Screenings darstellen, in der PLCO-Studie mit jährlichen PSA-Tests und zusätzlichen DRU wahrscheinlich häufiger noch rechtzeitig entdeckt worden.
Beim Vergleich der jeweiligen Screening- und Kontroll-Kollektive in der ERSPC und der PLCO-Studie wird deutlich, dass allenfalls die europäische Studie als kontrolliert anzuerkennen ist. Die Umstände in den USA führten dazu, dass der Screening-Gruppe im Grunde genommen nur eine weniger stark gescreente Gruppe gegenüberstand. Insofern sei das wissenschaftlich allerdings abwegige Gedankenexperiment erlaubt, der amerikanischen Screening-Gruppe die europäischen Kontroll-Gruppe entgegenzusetzen. Bei einer solchen Manipulation reduzierte sich die durch Prostatakrebs bedingte Mortalitätsrate in neun Jahren um ca. 50%. Zumindest gehen Überlegungen der ERSPC-Autoren dahin, dass die gewählten Vierjahresintervalle zu lang sein könnten.
Prostatakrebs-Diagnosen im Rahmen eines Screening-Programms sind mit einem hohen Prozentsatz an Überdiagnosen und den daraus resultierenden Übertherapien
mitsamt höchst unerwünscher Begleit-effekte verbunden. In der ERSPC wurden 50% Überdiagnosen registriert, d.h. bei jedem zweiten mit einer
Prostatakrebs-
Die Diskussion um Nutzen und Risiko eines Prostatakrebs-Screenings wird bei der Komplexität der jeweiligen Standpunkte sicher nicht so schnell verstummen.
Die Fortführung der ERSPC und der PLCO-Studie wird erst in einigen Jahren frische Daten liefern. Aber auch wenn sich dabei zweifelsfrei herausstellte, dass
sich durch Screening die Prostatakrebs-spezifische Mortalitätsrate senken lässt, bliebe das Problem der Überdiagnose und Übertherapie doch wohl auf unabsehbare
Zeit bestehen. Vieleicht liefern aber auch andere zur Zeit laufende größere Studien Argumente für die eine oder andere Seite. Das sind insbesondre die Prostate
Cancer Intervention Versus Observation Trial (PIVOT) in den USA und die Prostate Testing for Cancer and Treatment (PROTECT)-Studie in Großbritannien.
Literatur:
[1] Schröder FH, Hugosson J, Roobol MJ, et al. 2009. Screening and prostate-cancer mortality in a randomized European study N Engl J Med 360:1320-1328.
[2] Andriole GL, Grubb RL, Buys SS, et al. 2009. Mortality results from a randomized prostate-cancer screening trial. N Engl J Med 360:1310-1319.
[3] Draisma G, Boer R, Otto SJ, et al. 2003. Lead times and overdetection due to prostate-specific antigen screening: estimates from the European Randomized Study of Screening for Prostate Cancer. J Natl Cancer Inst. 95:868-878.
© 2003-2026 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
