
erektion — ejakulation — penis — hoden — endokrinologie — fertilität — genetische aspekte — aging male — varia
Epidemiologische, pathophysiologische und therapeutische Korrelationen
Die unabhängige Verbindung von LUTS und ED ist durch zahlreiche epidemiologische Studien gut belegt. Gemeinsame pathophysiologische Mechanismen umfassen die verminderte Verfügbarkeit von NO, erhöhte Aktivitäten des α1-Adrenorezeptorsystems und der Rho-
Symptome des unteren Harntrakts (LUTS, lower urinary tract symptoms) wie auch erektile Dysfunktion (ED) treten einzeln oder gemeinsam
bei zahlreichen Männern bereits im mittleren Lebensabschnitt in Erscheinung und sind im Alter weit verbreitete, typische Männerleiden, die
mit einer beträchtlichen Einbuße an Lebensqualität einhergehen. In den letzten Jahren haben epidemiologische Studien eine Reihe von Beweisen
für eine vom Alter und Begleiterkrankungen wie Bluthochdruck oder Diabetes mellitus unabhängige Verbindung von LUTS und ED geliefert. Als
Erklärung hierfür werden verschiedene pathophysiologische Mechanismen in Betracht gezogen: Verringerte Bioverfügbarkeit von Stickstoffmonoxid,
erhöhte Rho-Kinase-Aktivierung, Hyperaktivität der α1-Adrenorezeptoren, Atherosklerose der Beckenarterien und Testosteronmangel. Hieraus ergeben
sich therapeutische Konsequenzen. Bei der medikamentösen und operativen Behandlung von LUTS sind mögliche Auswirkungen hinsichtlich einer
Störung der Sexualfunktionen zu berücksichtigen. Mit Phosphodiesterase-5 (PDE5)-Hemmern den heute favorisierten oralen ED-Therapeutika
werden auch günstige Effekte bei LUTS erzielt [1-3].
-
Miktionsstörungen in Form obstruktiver LUTS (verzögerter Miktionsbeginn, Harnstrahlabschwächung, Nachträufeln, Restharnbildung,
Harnstottern) und irritativer LUTS (Dysurie, Pollakisurie, Nykturie, Algurie, Strangurie, imperativer Harndrang) sind bei Männern mit
fortschreitendem Alter weit verbreitet. Desgleichen steigt die Prävalenz von ED im Alter erheblich an. Im vergangenen Jahrzehnt wurden
Verbindungen zwischen LUTS und ED auf epidemiologischer, pathophysiologischer und therapeutischer Ebene intensiv untersucht.
-
Die ausgeprägte Korrelation von LUTS und ED wird aus den Ergebnissen einer Reihe longitudinaler und Querschnittsstudien deutlich (Tabelle 1):
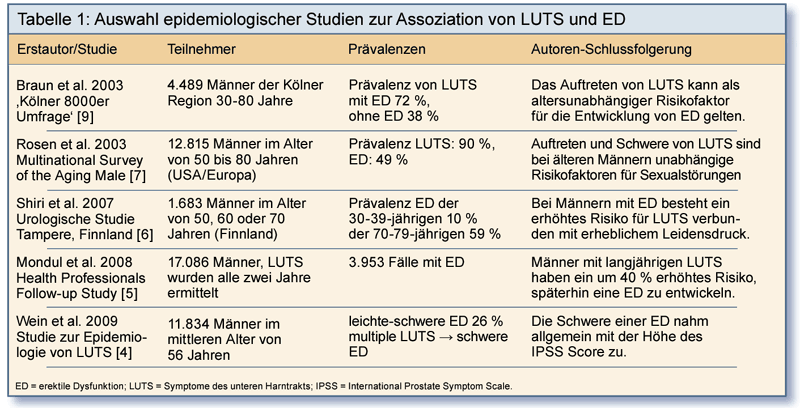 In einer Querschnittsstudie zur Erfassung des Einflusses von LUTS auf die männliche sexuelle Gesundheit wurden Daten von 11.834 Männern im mittleren
Alter von 56 Jahren in den USA, Großbritannien und Schweden analysiert [4]: Nahezu 30% der Männer mit LUTS gaben an, dass sich durch die Symptome
ihre Freude an sexueller Betätigung vermindert hatte, und bei 25% waren LUTS der Grund für ein eingeschränktes Sexualleben. Bei Männern mit
mehreren LUTS wurde vermehrt eine schwere ED diagnostiziert, und sie litten häufig unter Ejakulationsstörungen und/oder Ejaculatio praecox.
Die Schwere einer ED nahm allgemein mit der Höhe des International Prostate Symptom Scale (IPSS) Score zu (Abb. 1). Das Risiko für ED war bei
Männern mit Bluthochdruck, Diabetes mellitus und Harndrang bei befürchteten Inkontinenzepisoden – insbesondere auch während sexueller
Aktivität – deutlich erhöht.
In einer Querschnittsstudie zur Erfassung des Einflusses von LUTS auf die männliche sexuelle Gesundheit wurden Daten von 11.834 Männern im mittleren
Alter von 56 Jahren in den USA, Großbritannien und Schweden analysiert [4]: Nahezu 30% der Männer mit LUTS gaben an, dass sich durch die Symptome
ihre Freude an sexueller Betätigung vermindert hatte, und bei 25% waren LUTS der Grund für ein eingeschränktes Sexualleben. Bei Männern mit
mehreren LUTS wurde vermehrt eine schwere ED diagnostiziert, und sie litten häufig unter Ejakulationsstörungen und/oder Ejaculatio praecox.
Die Schwere einer ED nahm allgemein mit der Höhe des International Prostate Symptom Scale (IPSS) Score zu (Abb. 1). Das Risiko für ED war bei
Männern mit Bluthochdruck, Diabetes mellitus und Harndrang bei befürchteten Inkontinenzepisoden – insbesondere auch während sexueller
Aktivität – deutlich erhöht.
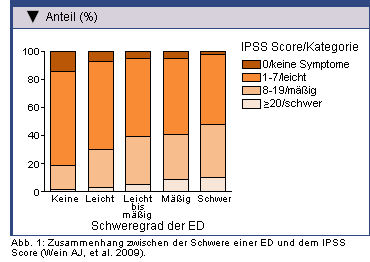
Die Auswirkung von ED auf die Inzidenz von LUTS und den damit verbundenen Leidensdruck war Gegenstand einer finnischen Umfrage bei Männern im Alter von 50, 60 oder 70 Jahren [6]. Nach einem Follow-up von fünf Jahren standen das Auftreten von LUTS und die Ausprägung des Leidensdrucks im Zusammenhang mit der Schwere der ED zu Studienbeginn.
In einer multinationalen Umfrage zur Verbindung von LUTS und Sexualproblemen bei 12.815 Männern im Alter von 50 bis 80 Jahren hatten vier von fünf Männern mit gravierenden LUTS eine erheblich eingeschränkte erektile Funktion, während das bei Männern ohne LUTS nur jeden Vierten betraf [7].
Das umfassendste Datenmaterial zur Situation bei deutschen Männern lieferte die ‚Kölner 8000er Umfrage‘ [8]. Die Fragebogenaktion
bei 8.000 repräsentativen 30- bis 80-jährigen Männern im Kölner Raum erbrachte für die Untersucher 4.489 auswertbare Rückmeldungen. Wie zu erwarten
zeigte sich ein steiler altersbedingter Anstieg der ED-Prävalenz von 2,3% in der untersten bis 53,4% in der obersten Alterskategorie. Von
insgesamt 44% der Teilnehmer an der Umfrage wurden LUTS angegeben. Zur Assoziation der ED-Daten mit Begleitkrankheiten erfolgte eine gesonderte
Analyse [9]: Die Prävalenz von LUTS bei Männern mit ED betrug 72% gegenüber 38% bei den Männern ohne Erektionsprobleme.
-
Die Verbindung von LUTS und ED wird insbesondere auch bei Betrachtung der vielfältigen Gemeinsamkeiten in der Pathophysiologie beider Leiden plausibel.
Andererseits liefern die gemeinsamen pathogenetischen Mechanismen nicht den schlüssigen Beweis eines kausalen Zusammenhangs.
|
|
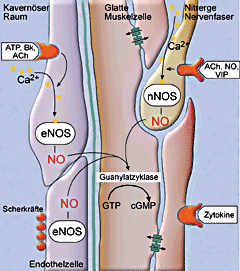
Im Penis sind verschiedene Stickstoffmonoxid-Synthasen (NOS) aktiv: In den nitrergen Nervenfasern erfolgt die NO-Produktion mit Hilfe
der neuronalen NOS (nNOS). Im Endothel wird NO über die endotheliale NOS (eNOS) gebildet. Zudem ist in den glatten Muskelzellen die
induzierbare NOS (iNOS) nachgewiesen worden (nicht dargestellt). In den glatten Muskelzellen aktiviert NO die Guanylatzyklase, deren
Funktion es ist, die Umwandlung von Guanosintriphosphat (GTP) in zyklisches Guanosinmonophosphat (cGMP) zu katalysieren. ACh = Acetylcholin, Bk = Bradykinin, VIP = vasoaktives intestinales Peptid. |
Verringerte Bioverfügbarkeit von NO: Störungen im Bereich der NO-cGMP-Reaktionskaskade
Hinreichend verfügbares Stickstoffmonoxid (NO) ist wesentliche Voraussetzung für die erektile Funktion. Über die NO-zyklisches Guanosinmonophosphat (cGMP)-
Das NO-Signal geht in der Zelle auf den Second Messenger cGMP über. In dem ringförmigen Molekül bildet Phosphat zwei Esterbindungen
aus, die durch das Enzym Phosphodiesterase Typ 5 (PDE5) gespalten und damit der NO-Effekt begrenzt wird. Im unteren Harntrakt ließ sich
PDE5 immunhistochemisch in Blutgefäßen und der glatten Muskulatur nicht aber in Epithelien lokalisieren. Die PDE5-
An diabetischen Ratten wurde gezeigt, dass die NO-Produktion durch die endotheliale NO-Synthetase (eNOS) in den Corpora cavernosa bei erhöhter
Aktivität des RhoA/Rho-Kinase-
Bei Patienten mit benigner Prostatahyperplasie (BPH) wurde in der Übergangszone der Prostata mittels kontrastverstärkter
Farb-
In jüngerer Zeit zeichnet sich eine Rolle der Androgene in der Pathogenese von LUTS ab. In einer Pilotstudie war eine niedrige
Konzentration an berechnetem freiem Testosteron im Serum bei Männern mit symptomatischer BPH negativ mit dem Detrusordruck bei
maximalem Harnfluss und dem Detrusordruck bei Beendigung des Harnflusses korreliert. Patienten mit Detrusorüberaktivität wiesen
sämtlich einen Spiegel an freiem Testosteron <60 pg/ml auf [23].
In einer Studie zur Beeinflussung der Sexualfunktion durch die α-Blocker-Therapie bei Männern mit BPH-bedingten LUTS korrelierten die
Verbesserung der IPSS-VD und IPSS-QoL Scores sowie die mittlere Harnflussrate signifikant mit dem IIEF-5 EF Score [24]. Es wurde geschlossen,
dass insbesondere die Besserung der Blasenentleerungsstörung und der Harnflussrate mit der Verbesserung der erektilen Funktion im Zusammenhang steht.
Von 1.724 Männern einer bevölkerungsbasierten Kohorte in Olmsted County, MN, im Alter von 40 bis 79 Jahren waren 263 (15,3%) Anwender von α-Blockern.
Deren Risiko für gestörte Sexualfunktionen aller Domänen war deutlich reduziert. Die Verbesserung der erektilen Funktion korrelierte bei Anwendung
von α-Blockern signifikant mit der Besserung von LUTS [25].
5α-Reduktaseinhibitoren
Anhand eines Literaturüberblicks wurde 2008 analysiert, inwieweit die erektile Funktion bei Patienten unter der Behandlung mit einem
5α-RI beeinflusst wird. Nachdem sich aus Studien zwischen 1992 und 2003 ein signifikantes, wenn auch geringes ED-Risiko bei Einnahme
von Finasterid gegenüber Placebo ergab, wiesen vier randomisierte, kontrollierte Studien zwischen 2003 und 2006 mit insgesamt 11.971
beteiligten BPH-Patienten, in denen die ED-Raten bei Einnahme von 0,5 mg Dutasterid versus Placebo verglichen worden waren, jeweils
keinen Unterschied zwischen der Behandlungs- und Placebo-
In der Combination of Avodart and Tamsulosin (CombAT)-Studie wurden 4.844 BPH-Patienten entweder mit Tamsulosin, mit Dutasterid
oder der Kombination von beiden behandelt. Nach 24 Monaten betrug die die Rate an Männern mit ED 3,8%, 6,0% bzw. 7,4% [27].
Transurethrale Resektion der Prostata
In einer aktuellen prospektiven Kohortenstudie wurde keine Beeinträchtigung der Sexualfunktion durch die TURP festgestellt. Vielmehr
kamen die Untersucher zu dem Schluss, dass eine präoperativ bestehende ED sogar langfristig gebessert werden kann [28]. Der Einfluss
der TURP auf die Sexualfunktion war während eines Follow-up von 12 Jahren ermittelt worden, wobei die Bewertung der erektilen Funktion
in zahlreichen Fällen sowohl vom Patienten als auch von dessen Partnerin erfolgte. Von 120 sexuell aktiven Männern aus der Kohorte
berichteten 27 mit vormals bestehender ED die Verbesserung der erektilen Funktion. Widersprüche zu anderen Untersuchungen erklären
sich unter Umständen dadurch, dass einige Studien retrospektiv waren und/oder der Grad einer präoperativ bestandenen ED nicht in die
Analyse einbezogen wurde. Aufgrund des Zusammenhangs zwischen LUTS und ED muss eben vielfach von einer eingeschränkten erektilen
Funktion vor einer BPH-veranlassten TURP ausgegangen werden.
Gacci et al. (2011) prüften die Wirksamkeit der Kombinationstherapie mit täglich 10 mg Vardenafil und 0,4 mg Tamsulosin bei
anhaltenden irritativen LUTS. Sie verteilten 60 Patienten nach einer Einlaufphase von zwei Wochen mit 0,4 mg Tamsulosin
randomisiert 1:1 auf eine Vardenafil- und eine Placebo-
Bei Patienten mit ED, die BPH-bedingt einen alpha-Blocker einnahmen, wurde geprüft, inwieweit sich die zusätzliche Behandlung
mit täglich 5 mg Tadalafil auf die LUTS und die erektile Funktion auswirkt [33]. Veränderungen des systolischen und diastolischen
Blutdrucks wie auch der Herzfrequenz wurden nicht beobachtet. Die Scores von IPSS und IIEF-5 verbesserten sich signifikant.
Die maximale Harnflussrate (Qmax) und das Residualharnvolumen blieben unbeeinflusst. Lediglich bei einer Subgruppe von
Patienten mit einer Qmax 10 ml/s bei Beginn der Studie erhöhte sich die Qmax von 7,97±1,44 auf 8,91±1,60 ml/s.
Hochregulierte Aktivität der RhoA/Rho-Kinase-Signalkette
In den letzten Jahren hat sich eine Reihe von Indizien für eine wichtige Rolle des RhoA/Rho-(ROCK)-Kinase-Reaktionsweges in der
Pathophysiologie kardiovaskulärer und urogenitaler Krankheiten angesammelt [11]. Man erhofft sich hiervon eine bedeutende neue
pharmakologische Option für zukünftige Therapiekonzepte bei Funktionsstörungen des Urogenitalsystems. Hyperaktivität auf der
RhoA/Rho-Kinase-
Erhöhte Kontraktilität der Glattmuskelzellen bei Hyperaktivität des α1-Adrenorezeptorsystems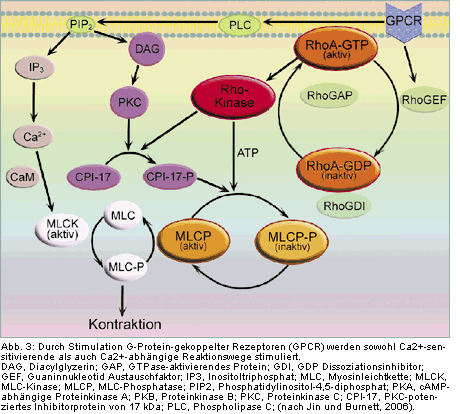
Erhöhte sympathische Aktivität des α-Adrenorezeptorsystems in den glatten Muskelzellen von Harnblase, Prostata und Penis ist Bestandteil
der Pathophysiologie von BPH/LUTS und ED [17]. In allen drei Organen einschließlich der Urethra sind α-Adrenorezeptorsubtypen lokalisiert. Mit
zunehmendem Alter scheint es zu einer Hyperaktivität des α-Adrenorezeptorsystems zu kommen. Ferner wurden bei Männern mit ED erhöhte
Spiegel an Noradrenalin im Serum gemessen. Zudem ergab sich eine Korrelation der Noradrenalinspiegel mit dem IPSS [18].
Atherosklerotische Veränderungen der Arterien im kleinen Becken
Atherosklerotische Veränderungen der Gefäße des Beckens, die der Blutversorgung von Penis, Harnblase und Prostata dienen, tragen zur
Entwicklung von LUTS und ED bei. Männer mit Risikofaktoren für Gefäßkrankheiten wie Diabetes mellitus, Fettstoffwechselkrankheiten,
Bluthochdruck und Nikotinabusus haben im Mittel einen höheren IPSS Score und einen niedrigeren IIEF Score als Männer ohne solche
Risikofaktoren [19]. Ferner bestand bei ED-Patienten mit verringerter systolischer Spitzengeschwindigkeit der
kavernösen Arterie ein Zusammenhang mit LUTS [20].
Rolle für Androgene in der Pathophysiologie von LUTS und ED?
Inwieweit Androgene eine Rolle bei der Entwicklung von ED spielen, wird kontrovers diskutiert und lässt sich nicht abschließend
beantworten. Für eine klinisch signifikante Beeinflussung der erektilen Funktion durch Testosteron bzw. Dihydrotestosteron (DHT)
sprechen Befunde, wonach die Noradrenalin-
LUTS und ED: Konsequenzen für die Therapie
In der medikamentösen Therapie moderater bis schwerer LUTS steht eine Reihe von -Blockern als erste Wahl zur Verfügung. Bei
zugrundeliegender BPH empfiehlt sich auch der Einsatz eines 5α-Reduktaseinhibitors (5α-RI), wobei die Kombination aus
5α-RI und α-Blocker das Fortschreiten der BPH am effektivsten bremst. Als ultima ratio bleiben Verfahren zur
Resektion der Prostata.
Einfluss medikamentöser und operativer Therapien bei LUTS auf erektile Dysfunktion
α-Adrenorezeptorenblocker
Einfluss von PDE5-Inhibitoren auf LUTS
In der Therapie von LUTS in Verbindung mit BPH sind α-Adrenorezeptorenblocker heute erste Wahl. Durch Inhibition der α1-Rezeptoren
kommt es zur Relaxation der prostatischen glatten Muskulatur. Ein ähnlicher Effekt wird auch für die kavernösen glatten Muskelzellen diskutiert,
so dass ein erektionsfördernder Effekt resultieren sollte.
Neuere Erkenntnisse messen androgenen Effekten sowohl bei der Integrität des penilen Gewebes als auch in der Physiologie der erektilen
Funktion eine wesentliche Rolle bei. Da androgene Effekte hauptsächlich über reduziertes Testosteron, d.h. Dihydrotestosteron (DHT)
zustande kommen, stellt sich die Frage, ob durch Hemmung der Reduktion von Testosteron mittels eines 5α-RI auch die erektile Funktion
beeinträchtigt wird. Davon wären in erster Linie ältere Männer betroffen, die aufgrund einer BPH mit einem 5α-RI behandelt werden.
Für Patienten mit LUTS im Zusammenhang mit BPH, die auf eine konventionelle Therapie nicht ansprechen oder für die eine solche kontraindiziert
ist, empfiehlt sich die Resektion der Prostata. Vorzugsweise wird heute die transurethrale Resektion der Prostata (TURP) durchgeführt, wobei
deren Einfluss auf die sexuelle Funktion in verschiedenen Studien unterschiedlich beurteilt wird. Mehrfach wurde für Patienten, die sich
einer TURP unterzogen hatten, ein signifikantes Risiko für ED bis hin zum kompletten Erektionsverlust beschrieben. Andererseits wurde auch
berichtet, dass sich die erektile Funktion nach TURP verbesserte.
Bei Patienten mit Erektionsproblemen bessern sich unter einer Therapie mit PDE5-Hemmern auch BPH-bedingte Miktionsbeschwerden (Tabelle 2).
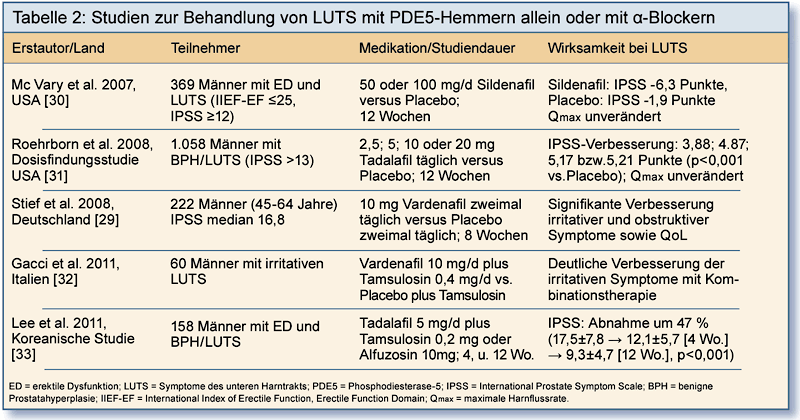 Für eine prospektive Placebo-kontrollierte Studie zu Vardenafil und LUTS wurden 222 Männer im Alter zwischen 45 und 64 Jahren
randomisiert [29]. Bei den 109 Männern der Vardenafil-
Für eine prospektive Placebo-kontrollierte Studie zu Vardenafil und LUTS wurden 222 Männer im Alter zwischen 45 und 64 Jahren
randomisiert [29]. Bei den 109 Männern der Vardenafil-
Literatur:
[1] Mazur DJ, Helfand BT, McVary KT, 2012.
Influences of neuroregulatory factors on the development of lower urinary tract symptoms/benign prostatic hyperplasia and erectile dysfunction in aging men.
Urol Clin North Am 39:77-88.
[2] Gacci M, Eardley I, Guiliano F, et al. 2011.
Critical analysis of the relationship between sexual dysfunctions and lower urinary tract symptoms due to benign prostatic hyperplasia.
Eur Urol DOI: 10.1016/j.eururo.2011.06.037
[3] Orabi H, Albertsen M, Lue TF, 2011.
Association of lower urinary tract symptoms and erectile dysfunction. Pathophysiological aspects and implications for clinical management.
Int J Impot Res 23:99-108.
[4] Wein AJ, Coyne KS, Tubaro A, et al. 2009.
The impact of lower urinary tract symptoms on male sexual health: EpiLUTS. BJU Int 103 Suppl3:33-41.
[5] Mondul AM, Rimm EB, Giovannucci E, et al. 2008.
A prospective study of lower urinary tract symptoms and erectile dysfunction. J Urol 179:2321-2326.
[6] Shiri R, Häkkinen J, Koskimäki J, et al. 2007.
Erectile dysfunction influences the subsequent incidence of lower urinary tract symptoms and bother. Int J Impot Res 19:317-320.
[7] Rosen R, Altwein J, Boyle P, et al. 2003.
Lower urinary tract symptoms and male sexual dysfunction: the multinational survey of the aging male (MSAM-7). Eur Urol 44:637-649.
[8] Braun M, Wassmer G, Klotz T, et al. 2000.
Epidemiology of erectile dysfunction: results of the ‘Cologne Male Survey’. Int J Impot Res 12:305-311.
[9] Braun MH, Sommer F, Haupt G, et al. 2003.
Lower urinary tract symptoms and erectile dysfunction: co-morbidity or typical ‘aging male’ symptoms? Results of the ‘Cologne Male Survey’.
Eur Urol 44:588.594.
[10] Fibbi B, Morelli A, Vignozzi L, et al. 2010.
Characterization of phosphodiesterase type 5 expression and functional activity in the human male lower urinary tract. J Sex Med 7(1 Pt 1):59-69.
[11] Gur S, Kadowitz PJ, Hellstrom WJG, 2011.
Rho/Rho-kinase as a therapeutic target for the male urogenital tract. J Sex Med 8:675-687.
[12] Jin L, Burnett L, 2006.
RhoA/Rho-kinase in erectile tissue: mechanism of disease and therapeutic insights. Clin Sci 110:153-165.
[13] Morelli A, Chavalmane AK, Filippi S, et al. 2009.
Atorvastatin ameliorates sildenafil-induced penile erections in experimental diabetes in inhibiting diabetes-induced RhoA/Rho-kinase signaling hyperactivation.
J Sex Med 6:91-106.
[14] Rajasekaran M, Wilkes N, Kuntz SE, Albi M, 2005.
Rho-kinase inhibition suppresses bladder hyperactivity in spontaneously hypertensive rats. Neurourol Urodyn 24:295-300. Clin Sci 110:153-165.
[15] Chavalmane AK, Comeglio P, Morelli A, et al. 2010.
Sex steroid receptors in male human bladder: expression and biological function. J Sex Med 7:2698-2713.
[16] Bivalacqua TJ, Champion HC, Usta MF, et al. 2004.
RhoARho-kinase suppresses endothelial nitric oxide synthase in the penis: A mechanism for diabetes-associated erectile dysfunction.
Proc Natl Acad Sci 101:9121-9126.
[17] Yassin A, Saad F, Hoesl CE, et al. 2006.
Alpha-adrenoceptors are a common denominator in the pathophysiology of erectile function and BPH/LUTS – implications for clinical practice.
Andrologia 38:1-12.
[18] Trussell JC, Kunselman AR, Legro RS, 2010.
Epinephrine is associated with both erectile dysfunction and lower urinary tract symptoms. Fertil Steril 93:837-842.
[19] Kim SO, Son KC, Im CM, et al. 2008.
The effects of risk factors for vascular disease on LUTS and erectile dysfunction. Eur Urol Suppl 7:131.
[20] El-Sakka AI, 2005.
Lower urinary tract symptoms in patients with erectile dysfunction: is there a vascular association? Eur Urol 48:319–325.
[21] Berger AP, Deibl M, Leonhartsberger N, et al. 2005.
Vascular damage as a risk factor for benign prostatic hyperplasia and erectile dysfunction. BJU Int 96:1073-1078.
[22] Waldkirch E, Uckert S, Schultheiss D, et al. 2008.
Non-genomic effects of androgens on isolated human vascular and nonvascular penile erectile tissue. BJU Int 101:71-75.
[23] Koritsiadis G, Stravodimos K, Mitropoulos D, et al. 2008.
Androgens and bladder outlet obstruction: a correlation with pressure-flow variables in a preliminary study. BJU Int 101:1542-1546.
[24] Jung JH, Jae SU, Kam SC, Hyun JS, 2009.
Correlation between lower urinary tract symptoms (LUTS) and sexual function in benign prostatic hyperplasia: impact of treatment of LUTS on sexual function.
J Sex Med 6:2299-2304
.
[25] Kumar R, Nehra A, Jacobson DJ, et al. 2009.
Alpha-blocker use is associated with decreased risk of sexual dysfunction. Urology 74:82-87.
[26] Canguven O, Burnett AL, 2008.
The effect of 5α-reductase inhibitors on erectile function. J Androl 29:514-523.
[27] Roehrborn CG, Siami P, Barkin J, et al. 2008.
The effects of dutasteride, tamsulosin and combination therapy on lower urinary tract symptoms in men with benign prostatic hyperplasia and prostatic enlargement:
2-year results from the CombAT study. J Urol 179:616-621.
[28] Mishriki SF, Grimsley SJS, Lam T, et al. 2011.
TURP and sex: patient and partner prospective 12 years follow-up study. BJU Int doi:10.1111/j,1464-410X.2011.10396.x
[29] Stief CG, Porst H, Neuser D, et al. 2008.
A randomised, placebo-controlled study to assess the efficacy of twice daily Vardenafil in the treatment of lower urinary tract symptoms secondary
to benign prostatic hyerplasia. Eur Urol 53:1236-1244.
[30] McVary KT, Monnig W, Camps Jr JL, et al. 2007.
Sildenafil citrate improves erectile function and urinary symptoms in men with erectile function and lower urinary tract symptoms associated with
prostatic hyperplasia: a randomized double-blind trial. J Urol 177:1071-1077.
[31] Roehrborn CG, McVary KT, Elion-Mboussa A, Viktrup L, 2008.
Tadalafil administered once daily for lower urinary tract symptoms secondary to benign prostatic hyperplasia: a dose finding study. J Urol 180:1228-1234.
[32] Gacci M, Vittori G, Siena G, et al. 2011.
Long term safety and efficacy of combination therapy with vardenafil 10 mg and tamsulosin 0,4 mg for persistent irritative LUTS:
a randomized double blind placebo controlled study. Eur Urol Suppl 10:123.
[33] Lee JY, Park SY, Jeong TY, et al. 2011.
Combined tadalafil and α-blocker therapy for benign prostatic hyperplasia in patients with erectile dysfunction: a multicenter, prospective study.
J Androl [E-pub ahead of print, August 25].
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
