
In nur wenigen Jahren hat sich die Therapie des fortgeschrittenen/meta-
In der weiteren Entwicklung sollte verstärktes Gewicht auf die Identifizierung prospektiv prädiktiver Prognosefaktoren gelegt
werden. Ein besonderer Glücksfall wäre es, diejenigen Tumormerkmale zu identifizieren, die Patienten unter Zytokin-Therapie
gelegentlich die Heilung der Krankheit oder längere Perioden des krankheitsfreien Überlebens bescherten.
Targeted Therapieregime mit Angiogenese-
und mTOR-Inhibitoren
Die bis vor Kurzem standardmäßige Behandlung des metastasierten Nierenzellkarzinoms (mNZK) mit Interferon alfa (IFN-α)
wies in einer Cochrane-Analyse von 2005 bescheidene Vorteile hinsichtlich des Gesamtüberlebens gegenüber Hormon- und Chemotherapien
auf [1]. Doch objektive Ansprechraten von 10% bis 15% und eine mittlere Überlebenszeit von 12 Monaten mit Immuntherapien
erscheinen höchst unbefriedigend. Mit der Einführung zielgerichteter
„targeted“ Therapien gegen Angiogenese-Faktoren (auch in Kombination mit IFN-α) und mammalian target of rapamycin
( mTOR)-Reaktionswege konnten die Ansprechraten wie auch die progressionsfreie Überlebenszeit deutlich gesteigert
und die Gesamtüberlebenszeit (z. T. signifikant) verlängert werden. Angiogenese- und mTOR-Inhibitoren liefern heute
das effektivste therapeutische Armamentarium zur Behandlung des fortgeschrittenen/metastasierten NZK [2-6].
-
Die Inzidenz von Nierenzellkrebs hat in den letzten Jahrzehnten ständig zugenommen. Männer sind um den Faktor
1,6 häufiger betroffen als Frauen. Bei etwa jedem dritten Patienten wird die Krankheit erst im metastasierten
Zustand diagnostiziert. Histologisch lassen sich klarzellige, papilläre, chromophobe, onkozytische und die sehr
seltenen Sammelrohrkarzinome unterscheiden. Mit Angaben bis zu 85% sind Klarzell-NZK der häufigste Subtyp.
-
Die Bildung neuer Blutgefäße, die aus den existierenden Adern aussprossen, ist für das Wachstum eines Primärtumors
|
|
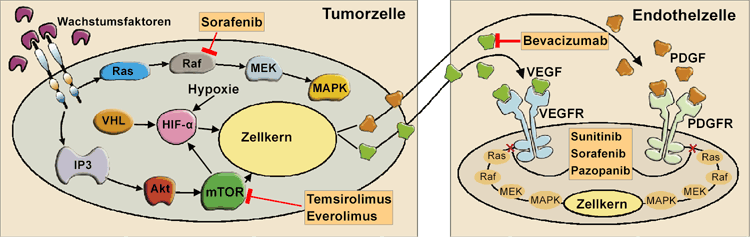
Abb. 1: Schematische Darstellung pathogenetischer Mechanismen beim Klarzell-Nierenzellkarzinom mit Angriffszielen
für targeted Therapien: Bei Verlust der Von-Hippel-Lindau (VHL)-Proteinfunktion kommt es infolge herabgesetzter Degradierung
des Transkriptionsfaktors Hypoxie-induzierbarer Faktor alpha (HIF-) zu vermehrter Expression der für die Tumorangiogenese
essenziellen Wachstumsfaktoren vesicular endothelial growth factor (VEGF) und platelet-derived growth factor (PDGF).
Die Aktivierung von mammalian target of rapamycin (mTOR) über die IP3/Akt-Kaskade stabilisiert HIF- und führt ebenfalls
zu vermehrter Bildung von VEGF unf PDGF. Die Angiogenese im Tumor wird insbesondere über die Aktivierung der VEGF-Rezeptoren
(VEGFR) induziert. Bevacizumab neutralisiert VEGF und Sunitinib, Sorafenib sowie Pazopanib inhibieren die Tyrosinkinase- |
Angiogenese wird auch über den mTOR-Signalweg induziert. Dabei kommt es ebenfalls über Interaktionen mit HIF- zu einer erhöhten Expressionsrate von VEGF und PDGF [7] (Abb. 1).
Nierenzellkarzinome gelten als immunsensitive Tumoren. Ihre Immunogenität erweist sich in der Resistenz gegen Bestrahlung und Chemotherapien sowie inFällen spontaner Regression. Die Behandlung des mNZK mit Zytokinen wie insbesondere IFN- oder Interleukin-2 war und ist eine Therapieoption, die heute aber weitgehend durch innovative Substanzen in den Hintergrund gedrängt wird. Doch auch targeted Therapien, die gegen das VEGF-System gerichtet sind, beinhalten eine immunologische Rationale. Die Sekretion von VEGF durch Tumorzellen wird für einen Funktionsverlust der dendritischen Zellen verantwortlich gemacht. Diese Antigen-präsentierenden Zellen sind für eine wirkungsvolle Anti-Tumorimmunität von entscheidender Bedeutung. Zudem hemmt VEGF die Entwicklung der T-Lymphozyten und trägt auch auf diese Weise zur Tumor-induzierten Immunsuppression bei.
Der mTOR-Reaktionsweg spielt eine Rolle bei der Interferon-Produktion in plasmazytoiden dendritischen Zellen [8].
Andererseits bestehen noch etliche Unklarheiten über mTOR-Effekte im Reifungsprozess der dendritischen Zellen. Dennoch wird
davon ausgegangen, dass über den mTOR-Signalweg die Bildung pro-inflammatorischer Zytokine reguliert, und die Reifung der
dendritischen Zellen in Richtung eines Th1-induzierenden Typs gelenkt wird [4].
-
Anti-Angiogenese spielt nach Entdeckung der Bedeutung von VHL in der Pathogenese des NZK heute eine wichtige Rolle
im Rahmen einer Reihe von Krebstherapien. Hierbei können anti-angiogene Substanzen einerseits als neutralisierende
Antikörper gegen den VEGF gerichtet sein und andererseits als kleine Moleküle die zytoplasmatische Tyrosinkinase-
Bevacizumab (Avastin®) ...
... ist ein humanisierter monoklonaler Antikörper, der an den VEGF bindet und damit dessen Interaktion mit VEGF-Rezeptoren
verhindert. Die Substanz kann bis zu einer Dosierung von 10 mg/kg alle zwei Wochen dosiert werden.
Bevacizumab plus Interferon alfa (AVOREN)
Die Zulassung von Bevacizumab in Kombination mit Interferon 2α (IFN-α) als First-line-Therapie des fortgeschrittenen
NZK erfolgte aufgrund der Ergebnisse einer doppelblinden Phase-III-Studie (AVOREN), bei der die Patienten randomisiert entweder
IFN-/Bevacizumab (n=322) oder IFN-α/Placebo (n=327) erhalten hatten. Die Patienten im IFN-α/Bevacizumab-Arm profitierten
gegenüber den Patienten im IFN-α/Placebo-Arm von einer höheren Ansprechrate (31% versus 12%, p<0,0001) und einem nahezu
doppelt so langen progressionsfreien Überleben (10,4 Monate versus 5,5 Monate, p<0,0001) [9].
Zusätzlich lieferte die Zulassungsstudie Daten, wonach die Kombination IFN-α/Bevacizumab nicht nur beim Klarzell-NZK sondern auch
Die endgültigen Ergebnisse der AVOREN-Studie lassen zwar den Trend zu längerem Gesamtüberleben in der IFN-α/Bevacizumab-
Die abschließenden Ergebnisse für das Gesamtüberleben in einer parallel gelaufenen amerikanisch/kanadischen Phase-III-Studie mit
Bevacizumab plus IFN-α bei Patienten mit mNZK verfehlten die im voraus definierten Kriterien für statistische Signifikanz gegenüber
der IFN-α-Monotherapie ganz knapp. Interessanterweise wurde aber bei Patienten, die unter der Kombinationstherapie einen Hypertonus
entwickelten, gegenüber den Patienten unter IFN-α-Monotherapie ein statistisch signifikanter Vorteil auch hinsichtlich des Gesamtüberlebens
registriert [11].
Interferon alfa aktiviert dendritische Zellen [12]. Diesbezüglich wird ein synergistischer antitumoraler Effekt mit
Bevacizumab vermutet. Hierin könnte auch die Begründung dafür zu suchen sein, dass in der AVOREN-Studie bei der Analyse einer Subgruppe
von Patienten, bei denen die IFN-α-Dosis von dreimal neun MIU auf dreimal sechs oder drei MIU reduziert worden war, keinerlei Verringerung
des progressionsfreien Überlebens in Kauf genommen werden musste (Abb. 2). Von der Reduktion der IFN-α-Dosis profitierten die Patienten
durch signifikant weniger Grad 3/4-Toxizitäten [13].
Sorafenib bei mNZK nach Zytokinen versus Placebo (TARGET)
In TARGET waren noch ausschließlich Klarzell-NZK behandelt worden. Seither hat sich Sorafenib auch bei NZK mit
Nicht-Klarzell-
Unter der Behandlung mit Sunitinib normalisierte sich bei Patienten mit einem fortgeschrittenen NZK die gestörte Entwicklung
der myeloischen Reihe, bei der die Bildung unverhältnismäßig vieler potenziell immunsuppressiver neutrophiler Lymphozyten
und eine beeinträchtigte Differenzierung immunstimulatorischer dendritischer Zellen zum „immune escape“ beitragen. Darüber
hinaus zeigte sich der prädiktive Wert vermehrter myeloischer dendritischer Zellen im peripheren Blut für ein verlängertes
progressionsfreies Überleben [21].
Pazopanib bei mNZK als Monotherapie
In einer Phase-III-Studie wurden 435 Patienten mit lokal fortgeschrittenem und/oder mNZK ohne und mit Zytokin-
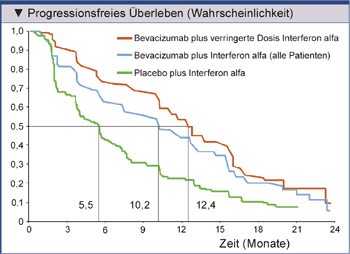
Abb. 2: Subgruppenanalyse der AVOREN-Studie von Patienten mit reduzierter Interferon alfa-Dosierung
(nach Melchiar, et al. 2008 [13]).
Sorafenib (Nexavar®) ...
... ist ein oraler Multikinase-Inhibitor der VEGF-Rezeptoren 1 bis 3, des PDGF-Rezeptors-, des Flt-3 und c-KIT. Darüber
hinaus ist Sorafenib der einzige verfügbare Inhibitor von Serin/Theonin-
In einer Phase-III-Studie wurden 903 Patienten mit vorausgegangener Immuntherapie randomisiert einem Sorafenib-Arm (400 mg
zweimal täglich) oder einem Placebo-Arm zugeordnet. Im Vergleich zu Placebo verbesserte Sorafenib das mediane progessionsfreie
Überleben signifikant (5,5 vs. 2,8 Monate, p<0,001). In der Cross-over zensierten Subgruppenanalyse errechnete sich ein statistisch
signifikanter Überlebensvorteil gegenüber Placebo (17,8 vs. 14,3 Monate). Häufigste Grad 3/4 Toxizitäten beinhalteten
Hand-Fuß-
... ist ein oraler Multikinase-Inhibitor der drei VEGFR (1-3), der PDGFR und wie auch von cKIT. Die Substanz ist uneingeschränkt
zur Behandlung des fortgeschrittenen und/oder metastasierten NZK zugelassen. Sunitinib zeichnet sich insbesondere durch positive
Effekte auf Bildung, Reifung und Funktion der dendritischen Zellen aus [referiert in 4].
Sunitinib versus IFN- bei nicht vorbehandeltem mNZK
In internationalen Therapierichtlinien wird Sunitinib neben Bevacizumab + IFN- und Pazopanib für nicht vorbehandelte Patienten
mit fortgeschrittenem NZK, deren prognostiziertes Risiko als gering oder mittel einzustufen ist, mit dem Evidenz-Level 1
empfohlen. Grundlage hierfür sind die Ergebnisse einer Phase-III-Studie, in der Sunitinib gegenüber IFN- als First-line-
Pazopanib (Votrient®) ...
ist wie Sorafenib und Sunitinib ein Multikinase-Inhibitor der VEGF 1, 2 und 3, der PDGF-Rezeptoren und wie auch von cKIT.
Die europäische Zulassungsbehörde EMA hat die Zulassung für Pazopanib zur Behandlung des fortgeschrittenen NZK erteilt.
Der Multi-Tyrosinkinase-
Aktuell wurden die Ergebnisse von zwei Studien publiziert: Bei fortgeschrittenem NZK ohne und mit Zytokin- oder Bevacizumab
enthaltender Vortherapie betrug das Gesamtansprechen 35 % mit einem medianen Anhalten über 68 Wochen. Das mediane
progressionsfreie Überleben belief sich auf 52 Wochen. Häufigste Nebenwirkungen waren Diarrhoe, Fatigue und
Haar-Depigmentierung [22].
Vorbehandlung
im Verhältnis 2:1 auf einen Pazopanib- und einen Placebo-Arm randomisiert. Die objektiven Ansprechraten betrugen 30% versus 3%
und das mediane progressionsfreie Überleben im Gesamtkollektiv 9,2 versus 4,2 Monate. In der therapienaiven Population waren
die Ergebnisse entsprechend 11,1 bzw. 2,8 Monate und in der mit Zytokin vorbehandelten Population 7,4 bzw. 4,2
Monate [23].
-
Die Serin/Threonin-Kinase mTOR ist ein hauptsächliches Ziel der so genannten IP3/Akt-Kaskade. Durch Hemmung von mTOR
werden Antitumor- und Antiangiogenese-
Temsirolimus (Torisel®) ...
... ist ein wasserlöslicher Ester von Rapamycin, der seine antitumoröse Aktivität in einer Reihe von Krebs-Modellen unter
Beweis gestellt hat. In präklinischen Untersuchungen wurde eine Hemmung der VEGF-Produktion in Tumorzellen nachgewiesen.
Zugleich waren die Proliferation von Endothelzellen und deren Morphogenese gestört. Temsirolimus ist zur Erstlinientherapie
für Patienten mit fortgeschrittenem Nierenzellkrebs und schlechter Prognose zugelassen.
Temsirolimus versus IFN- oder die Kombination aus beiden bei mNZK mit hohem Risiko (ARCC-Studie)
Das mediane Gesamtüberleben von Patienten mit zuvor nicht behandeltem mNZK und schlechter Prognose nach Memorial Sloan-Kettering
Cancer Center (MSKCC)-Einteilung war unter einer Therapie mit Temsirolimus signifikant länger (10,9 Monate) als unter einer
Therapie mit IFN- (7,3 Monate). Die zusätzliche Gabe von Temsirolimus zu IFN- verbesserte das Gesamtüberleben nicht. Als
häufigste Nebenwirkungen (Grad 3/4) der Behandlung mit Temsirolimus traten Anämie (20%), Asthenie (11%) Hyperglykämie (11%)
und Dyspnoe (9%) auf [24].
Bemerkenswert ist, dass in der ARCC-Studie die Kombination von Temsirolimus und IFN-α kein besseres Ergebnis erzielt
hat als die INF-α-Monotherapie. Bei Hemmung von mTOR und gleichzeitiger Induktion einer entzündlichen Immunreaktion
durch IFN-α könnte es zu einer Th2-Verschiebung der humuralen Immunantwort kommen. Möglicherweise liegt hierin auch
die Ursache für die vermehrt beobachteten schweren Nebenwirkungen unter der Kombinationstherapie.
Temsirolimus (Torisel®) ...
... ist ein oral verfügbarer mTOR-Inhibitor. Durch die Hemmung von mTOR werden zugleich Tumorzellwachstum- und -proliferation,
der Tumorzellmetabolismus, wie auch die Angiogenese gehemmt. Everolimus ist für Patienten mit mNZK zugelassen, bei denen
es während oder nach einer gegen VEGF/VEGFR gerichteten Therapie zur Krankheitsprogression kommt.
Everolimus versus Placebo bei vorbehandeltem mNZK (RECORD-1-Studie)
In der Phase-III-Zulassungsstudie waren Patienten mit mNZK nach Vorbehandlung mit Sunitinib und/oder Sorafenib sowie auch
nach vorausgegangener Therapie mit Zytokinen oder Bevacizumab eingeschlossen. Die insgesamt 416 Patienten wurden randomisiert
im Verhältnis 2:1 der Einnahme von täglich 10 mg Everolimus oder eines entsprechenden Placebo zugewiesen. Nach Eintreten
von 191 Progressionsereignissen wurde die Prüfung nach der zweiten Interimsanalyse abgebrochen. Von den Ereignissen traten
101 (37%) im Everolimus-Arm und 90 (65%) im Placebo-Arm auf. Das mediane progressionsfreie Überleben betrug median 4,9 Monate
bzw. 1,9 Monate. Von den Patienten aus dem Placebo-Arm wechselten 81% nach einer Krankheitsprogression in den Everolimus-Arm.
Zumeist leicht bis mäßig schwere Nebenwirkungen traten signifikant häufiger unter Everolimus- gegenüber Placebo-Einnahme auf:
Stomatitis 40% versus 8%, Hautausschlag 25% versus 4% und Fatigue 20% versus 16%. Von 22 Pneumonitis-Fällen im
Everolimus-Arm waren drei vom Grad 3 [25].
-
Nach Versagen einer Erstlinientherapie bei fortgeschrittenem/metastasiertem NZK folgt in zahlreichen Fällen eine
Zweitlinientherapie. Hierzu liegen Ergebnisse einschlägiger Studien wie Sorafenib nach Versagen einer Immuntherapie
[17] oder Everolimus nach Vorbehandlung mit Sunitinib und/oder Sorafenib [25] vor. Doch dabei handelt
In der internationalen RECORD-III-Studie wird die Effektivität der Kombinationstherapie Everolimus gefolgt von Sunitinib gegen die umgekehrte Therapiereihenfolge verglichen. Ferner sollen die möglichen Zweischritt-Sequenztherapien zwischen Bevacizumab, Temsirolimus und Sunitinib geprüft werden.
 Bei der Auswahl der jeweils am geeignetsten erscheinenden Therapie muss in erster Linie berücksichtigt werden,
welche Behandlung welchem Patienten je nach Krankheitsstadium und Performance-Status zumutbar ist. Das
Nebenwirkungsspektrum jeder Substanz kann hierbei Orientierungshilfe leisten.
Bei der Auswahl der jeweils am geeignetsten erscheinenden Therapie muss in erster Linie berücksichtigt werden,
welche Behandlung welchem Patienten je nach Krankheitsstadium und Performance-Status zumutbar ist. Das
Nebenwirkungsspektrum jeder Substanz kann hierbei Orientierungshilfe leisten.
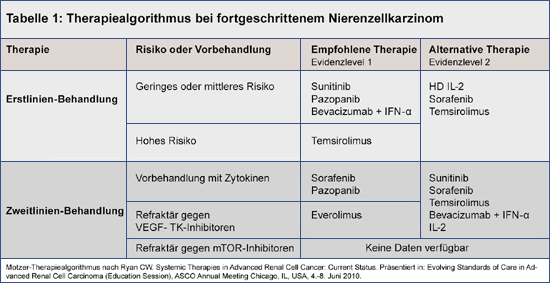
Bis dato fehlen prädiktive Biomarker, mit denen in der Klinik das Ansprechen auf eine bestimmte Therapie vorausgesagt werden könnte. Daher wird allgemein ein Vorgehen anhand des MSKCC-Risikoprofils der Patienten empfohlen (Tabelle 1).
Auch wenn die Frage der günstigsten Sequenztherapien weitgehend geklärt sein sollte, bleibt die Herausforderung, die
richtige Therapie mit dem richtigen Patienten zusammenzubringen. Dieses Problem lässt sich letztendlich nur mithilfe
geeigneter prädiktiver Marker lösen.
-
Von Kombinationstherapien – gleich ob die kombinierten Substanzen verschiedene Stufen entlang desselben Signalweges
blockieren (vertikale Inhibition), oder ob sie getrennte Signalwege (horizontale Inhibition) zum Ziel haben – wird
ein effizienteres Therapieansprechen erwartet. Als grundsätzliches Problem der Kombination von Wirksubstanzen stellt
Auch die Kombinationen von Sunitinib und Temsirolimus erwiesen sich bereits im Phase-I-Stadium als nicht tolerierbar
 toxisch. Weitere mögliche Kombinationen zeigten in kleinen Serien zum Teil vielversprechende Effektivität bei
akzeptabler Tolerierbarkeit, oder es liegen für sie noch keine Daten vor (Tabelle 2; zitiert in
[2, 3]).
toxisch. Weitere mögliche Kombinationen zeigten in kleinen Serien zum Teil vielversprechende Effektivität bei
akzeptabler Tolerierbarkeit, oder es liegen für sie noch keine Daten vor (Tabelle 2; zitiert in
[2, 3]).
In einer Phase-II-Studie erwies sich die Kombination Bevacizumab plus Everolimus bei Patienten mit fortgeschrittenem Klarzell-NZK als First-line-Therapie als auch nach Vorbehandlung mit Sunitinib und/oder Sorafenib als aktiv. Es kam zu keiner kumulativen Toxizität [27].
Erwähnenswert ist eine Phase-III-Studie, in der Bevacizumab plus INF- gegen Bevacizumab plus Temsirolimus verglichen
wird. Die Erwartungen sind hoch gesteckt: Jeder Arm soll mit 400 NZK-Patienten besetzt werden, und es wird auf eine
Verlängerung der progressionsfreien Überlebenszeit von 10,2 Monaten mit Bevacizumab plus INF- (AVOREN-Studie) auf ca.
13,5 Monate im Bevacizumab/Temsirolimus-Arm gehofft. Einen Dämpfer erhielten diese Bemühungen durch die Ergebnisse
einer Phase-II-Studie (TORAVA) mit drei Armen (Bevacizumab/IFN-, Sunitinib, Bevacizumab/Temsirolimus), die auf dem
diesjährigen ASCO präsentiert wurden: Danach war das Toxizitätsprofil der Kombination Bevacizumab/Temsirolimus
ungünstiger als erwartet, und die Effektivitätsparameter ließen keine synergistische/additive Aktivität der Kombination
erkennen [28].
Prof. Dr. Dr. J.F. Schindler, Mülheim
Prof. Dr. Dr. D. Rohde, Duisburg
Literatur:
[1] Coppin C, Porzsolt F, Awa A, et al. 2005.
Immunotherapy for advanced renal cell cancer. Cochrane Database Syst Rev 25:CD001425.
[2] Kirchner H, Strumberg D, Bahl A, Overkamp F, 2010.
Patient-based strategy for systemic treatment of metastatic renal cell carcinoma. Expert Rev Anticancer Ther 10:585-596.
[3] Calabrò F, Sternberg CN, 2010.
Novel tatgeted therapy for advanced renal carcinoma: trials in progress. Curr Opin Urol 20:382-387.
[4] Laschos KA, Papazisis KT, Kontovinis LF, et al. 2010.
Targeted treatment for metastatic renal cell carcinoma and immune regulation. J BUON 15:235-240.
[5] Merseburger AS, Waalkes S, Kuczyk MA, 2009.
Aktuelles zur Systemtherapie des metastasierten Nierenzellkarzinoms. Urologe 48:983-989.
[6] Ringhoffer M, Rinnab L, Küfer R, Greiner J, 2009.
Systemtherapie des metastasierten Nierenzellkarzinoms. Von der Vielzahl der Möglichkeiten zur therapeutischen Strategie. Urologe 48:1308-1317.
[7] Robb VA, Karbowniczek M, Klein-Szanto AJ, Henske EP 2007.
Activation of the mTOR signaling pathway in renal clear cell carcinoma. J Urol 177:346-352.
[8] Cao W, Manicassamy S, Tang H, et al. 2008.
Toll-like receptor mediated induction of type I interferon in plasmacytoid dendritic cells requires the rapamycin-sensitive.PI(3)K-mTOR-p70S6K pathway. Nat Immunol 9:1157-1164.
[[9] Escudier B, Pluzanska A, Koralewski P, et al. 2007.
Bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma: a randomised, double-blind phase III trial. Lancet 370:2103-2111.
[10] Escudier B, Bellmunt J, Négrier S, et al. 2010.
Phase III trial of bevacizumab plus interferon alfa 2a in patients with metastatic renal cell carcinoma (AVOREN): final analysis of overall survival. J Clin Oncol 28:2144-2150.
[11] Rini BI, Halabi S, Rosenberg JE, et al. 2010.
Phase III trial of bevacizumab plus interferon alfa versus interferon alfa monotherapy in patients with metastatic renal cell carcinoma: final results of CALGB 90206. J Clin Oncol 28:2137-2143.
[12] Tamir A, Jordan WJ, Ritter M, et al. 2005.
Interferon-2a is sufficient for promoting dendritic cell immunogenicity. Clin Exp Immunol 142:471-480.
[13] Melchiar B, Koralewski P, Ravaud A, et al. 2008.
First-line bevacizumab combined with reduced dose interferon-2a is active in patients with metastatic renal cell carcinoma. Ann Oncol 19:1470-1476.
[14] Wilhelm SM, Carter C, Tang L, et al. 2004.
Bay 43-9006 exhibits broad spectrum oral antitumor activity and targets RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis. Cancer Res 64:7099-7109.
[15] Escudier B, Eisen T, Stadler WM, et al. 2007.
Sorafenib in advanced clear-cell renal-cell carcinoma. N Engl J Med 356:125-134.
[16] Guevremont C, Jeldres C, Perrotte, Karakiewicz PI, 2009.
Sorafenib in the management of metastatic renal cell carcinoma. Curr Oncol 16(Suppl. 1):S27-S32.
[17] Bukowski RM, Eisen T, Szczylik C, et al. 2007. Final results of the randomized phase III trial of sorafenib in advanced renal cell carcinoma: Survival and biomarker analysis.
J Clin Oncol ASCO Annual Meeting Proceedings Part I. Vol 25, No. 18S (Suppl.): 5023.
[18] Amato RJ, Harris PDalton M, et al. 2007.
A phase II trial of intra-patient dose-escalatied sorafenib in patients (pts) with metastatic renal cancer (MRCC).
J Clin Oncol ASCO Annual Meeting Proceedings Part I. Vol 25, No. 18S (Supp.): 5026.
[19] Massard C, Zonierek J, Gross-Goupil M, et al. 2010.
Incidence of brain metastases in renal cell carcinoma treated with sorafenib. Ann Oncol 21:1027-1031.
[20] Motzer RJ, Hutson TE, Tomczak P, et al. 2009.
Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma. J Clin Oncol 27:3584-3590.
[21] Van Cruijsen H, van der Veldt AA, Vroling L, et al. 2008.
Sunitinib-induced myeloid lineage redistribution in renal cell cancer patients: CD1c+ dendritic cell frequency predicts progression-free survival. Clin Cancer Res 14:5884-5892.
[22] Hutson TE, Davis ID, Machiels J-PH, et al. 2010.
Efficacy and safety of pazopanib in patients with metastatic renal cell carcinoma. J Clin Oncol 28:475-480.
[23] Sternberg CN, Davis ID, Mardiak J, et al. 2010.
Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. J Clin Oncol 28:1061-1068.
[24] Hudes G, Carducci M, Tomczak P, et al. 2007.
Temsirolimus interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med 356:2271-2281.
[25] Motzer RJ, Escudier B, Oudard S, et al. 2008.
Efficacy of everolimus in advanced renal cell carcinoma: a double-blind, randomised, placebo-controlled phase III trial. Lancet 372:449-456.
[26] Feldman DR, Baum MS, Ginsberg MS, et al. 2009.
Phase I trial of bevacizumab plus escalated doses of sunitinib in patients with metastatic renal cell carcinoma. J Clin Oncol 27:1432-1439.
[27] Hainsworth JD, Spigel DR, Burris HA, et al. 2010.
Phase II trial of bevacizumab and everolimus in patients with advanced renal cell carcinoma. J Clin Oncol 28:2131-2136.
[28] Escudier BJ, Negrier S, Gravis G, et al. 2010.
Can the combination of temsirolimus and bevacizumab improve the treatment of metastatic renal cell carcinoma (mRCC)? Results of the randomized TORAVA phase II trial. J Clin Oncol 28:7s, (suppl; abstr 4516).
© 2003-2026 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
