
Durch den Androgenrezeptor dysregulierter Spindelkontrollpunkt führt zu Docetaxel-Resistenz
Docetaxel ist Standard in der Erstlinienchemotherapie für Patienten mit metastasiertem CRPC. Doch Docetaxel-Resistenz ist unausweichlich und entwickelt sich oft in kurzer Zeit. Wird Docetaxel beim kastrationssensitiven Tumor (CSPC) hingegen zusammen mit Androgendeprivationstherapie (ADT) eingesetzt, werden dauerhaftere Ansprechen und verbesserte Ergebnisse erreicht. Offenbar führt abweichende Signalwirkung des Androgenrezeptors (AR) im CRPC zu schnellerer Docetaxel-Resistenz. Aktuell wird nachgewiesen, dass AR den Spindelkontrollpunkt (Mitose-Checkpoint) dysregulieren.
Die Rolle der AR bei Docetaxel-Resistenz unter hormonsensitiven Bedingungen wurde mit den androgenabhängigen LNCaP- und VCaP-Zelllinien bewertet. Als Modelle für die Bewertung der AR-Reaktivierung bei Kastrationsresistenz auf die Docetaxel-Sensitivität dienten AR-überexprimierende LNCaP-AR- und AR-V7 exprimierende 22Rv1-CRPC-Zelllinien.
AR-induzierte Docetaxel-Resistenz in CSPC- und CRPC-Zellen
Die hohe Apoptoserate der LNCaP- und VCaP-Zelllinien bei Docetaxel-Behandlung unter ADT-Bedingungen ist bei Supplementierung mit dem synthetischen Androgen R1881 signifikant reduziert.
Während Apoptose in CSPC-Zellen sogar bei niedriger Docetaxel-Dosis aktiviert war, ließ sich das mit CRPC-Zellen auch bei
hoher Docetaxel-Dosierung nicht erreichen.
Insgesamt ließ sich zeigen, dass auf Docetaxel eine verringerte Sensitivität und eine verminderte Apoptoseantwort aufweisen,
was darauf hinweist,
dass die Docetaxel-Resistenz über onkogene AR-Signalwege gefördert wird.
Docetaxel-Resistenz durch dysregulierten Mitose-Checkpoint
Bei einer Docetaxel-Behandlung kommt es zur Dysregulierung des Mitose-Checkpoints. Sowohl in LNCaP- als auch VCaP-Zellen
ist die Docetaxel-Sensitivität
unter ADT-Bedingungen gegenüber den Bedingungen bei aktivierten AR um mehr als das 2,5-Fache erhöht. Das deutet darauf
hin, dass die Aktivierung
der AR den vorzeitigen Ausstieg aus dem Mitose-Arrest („mitotic slippage“) als einen Mechanismus der Docetaxel-Resistenz induziert.
Verfrühte Anaphase bei von AR negativ regulierter AURKB
Die Aurorakinase B (AURKB) ist für die Aktivierung des Spindelkontrollpunkts und zur Verhinderung einer verfrühten Anaphase essenziell,
und die Kinesin-13-Proteine KIF2B und MCAK haben regulatorische Funktionen im Rahmen der Kinetochorfunktion.
Die Expression der Gene AURKB, KIF2B und MCAK ist bei Behandlung mit Enzalutamid sowohl unter hormonsensitiven
als auch unter kastrationsresistenten Bedingungen erhöht. Die negative Regulierung des Spindelkontrollpunkts mit vorzeitiger
Anaphase durch die AR in voller Länge bestätigte sich auch für die AR-V7.
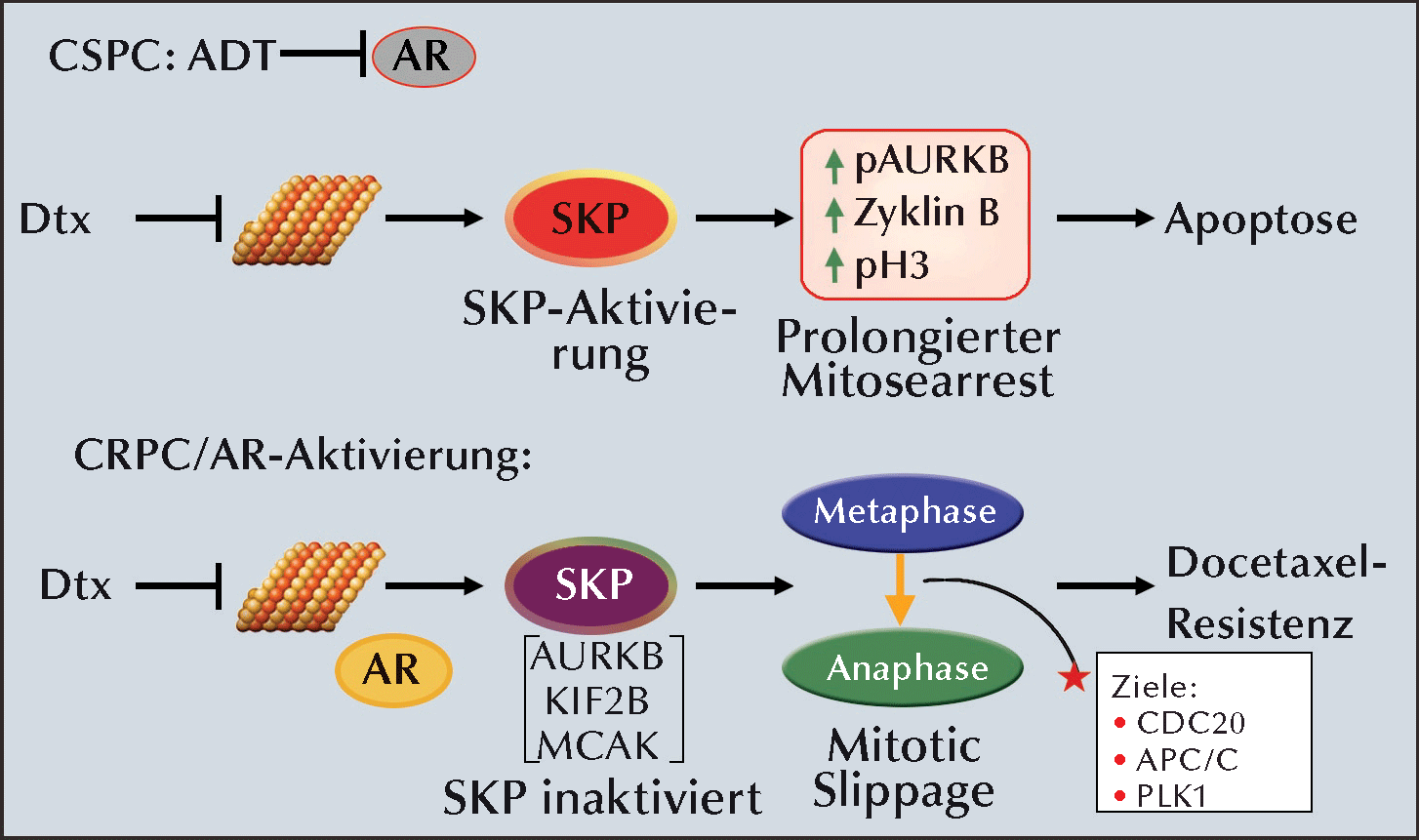
|
|
Abb.: Modell der AR-dysregulierten Mitose-Checkpoint-Signalübertragung und der Docetaxel (Dtx)-Resistenz: (Oben) Dtx-Zytotoxizität
bei AR-Inhibition in CSPC-Zellen. Docetaxel bindet an Mikrotubuli und induziert die Aktivierung des Spindelkontrollpunkts (SKP), die zu prolongiertem
Mitosearrest und Apoptose führt. (Unten) Docetaxel-Resistenz bei aktivierten oder anomal reaktivierten AR, wie im CRPC häufig vorkommen. Die aktivierten AR
inhibieren die SPK-Aktivierung, schränken den Mitosearrest ein, bedingen die vorzeitiger Mitoseprogression (mitotic slippage) und führen zu Docetaxel-Resistenz.
Targeting der Anaphase-Aktivatoren wie CDC20, APC/C oder PLK1 ist eine potenzielle therapeutische Strategie zur Überwindung der Docetaxel-Resistenz beim CRPC.
APC/C, anaphase-promoting complex/cyclosome; PLK1, polo-like kinase 1 |
Es zeigte sich, dass Docetaxel-Resistenz in CRPC-Zellen durch Mechanismen vermittelt wird, die die Aktivierung des
Spindelkontrollpunkts übersteuern.
Die Blockade des Mitose-Austritts könnte als therapeutisches Ziel dienen, um Docetaxel-Resistenz im CRPC zu überwinden (Abb.).
❏ Docetaxel-Resistenz in CRPC-Zellen ist durch Mechanismen vermittelt, die die Aktivierung des Spindelkontrollpunkts übersteuern, was darauf hindeutet, dass eine Blockade des Mitose-Austritts ein aussichtsreiches therapeutisches Ziel sein könnte, um Docetaxel-Resistenz beim CRPC zu überwinden.
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz