Harnblasenkrebs: |
 Die molekulare Subtypisierung des Harnblasenkarzinoms wird im Hinblick auf eine präzisere
Therapieallokation und personalisierte Therapien anhand zahlenmäßig expandierenden Kohorten betrieben.
Mit anwachsendem Probenumfang erhöht sich die statistische Power bei der Identifizierung und
Charakterisierung von Subtypen. Zugleich werden Verzerrungen durch die Probenauswahl minimiert.
Die molekulare Subtypisierung des Harnblasenkarzinoms wird im Hinblick auf eine präzisere
Therapieallokation und personalisierte Therapien anhand zahlenmäßig expandierenden Kohorten betrieben.
Mit anwachsendem Probenumfang erhöht sich die statistische Power bei der Identifizierung und
Charakterisierung von Subtypen. Zugleich werden Verzerrungen durch die Probenauswahl minimiert.
 Von einer singapurisch-französischen
Arbeitsgemeinschaft wurde eine als Meta-Kohorte bezeichnete Zusammenstellung von
2.411 Blasenkrebs-Genexpressionsprofilen aus unterschiedlichen Quellen in Bezug auf
spezifische molekulare Subtypen analysiert.
Von einer singapurisch-französischen
Arbeitsgemeinschaft wurde eine als Meta-Kohorte bezeichnete Zusammenstellung von
2.411 Blasenkrebs-Genexpressionsprofilen aus unterschiedlichen Quellen in Bezug auf
spezifische molekulare Subtypen analysiert.
 Allgemein zugängliche Genexpressionsdaten wurden zur Meta-Kohorte vereint und neu analysiert.
Da Hochrisiko-Tumore des nicht muskelinvasiven Blasenkarzinoms (NMIBC) Eigenschaften des muskelinvasiven
Blasenkarzinoms (MIBC) aufweisen können, wurden NMIBC- und MIBC-Tumore gemeinsam
analysiert. Damit werden Vergleiche zwischen den zwei Progressionswegen auf molekularer Ebene ermöglicht.
Allgemein zugängliche Genexpressionsdaten wurden zur Meta-Kohorte vereint und neu analysiert.
Da Hochrisiko-Tumore des nicht muskelinvasiven Blasenkarzinoms (NMIBC) Eigenschaften des muskelinvasiven
Blasenkarzinoms (MIBC) aufweisen können, wurden NMIBC- und MIBC-Tumore gemeinsam
analysiert. Damit werden Vergleiche zwischen den zwei Progressionswegen auf molekularer Ebene ermöglicht.
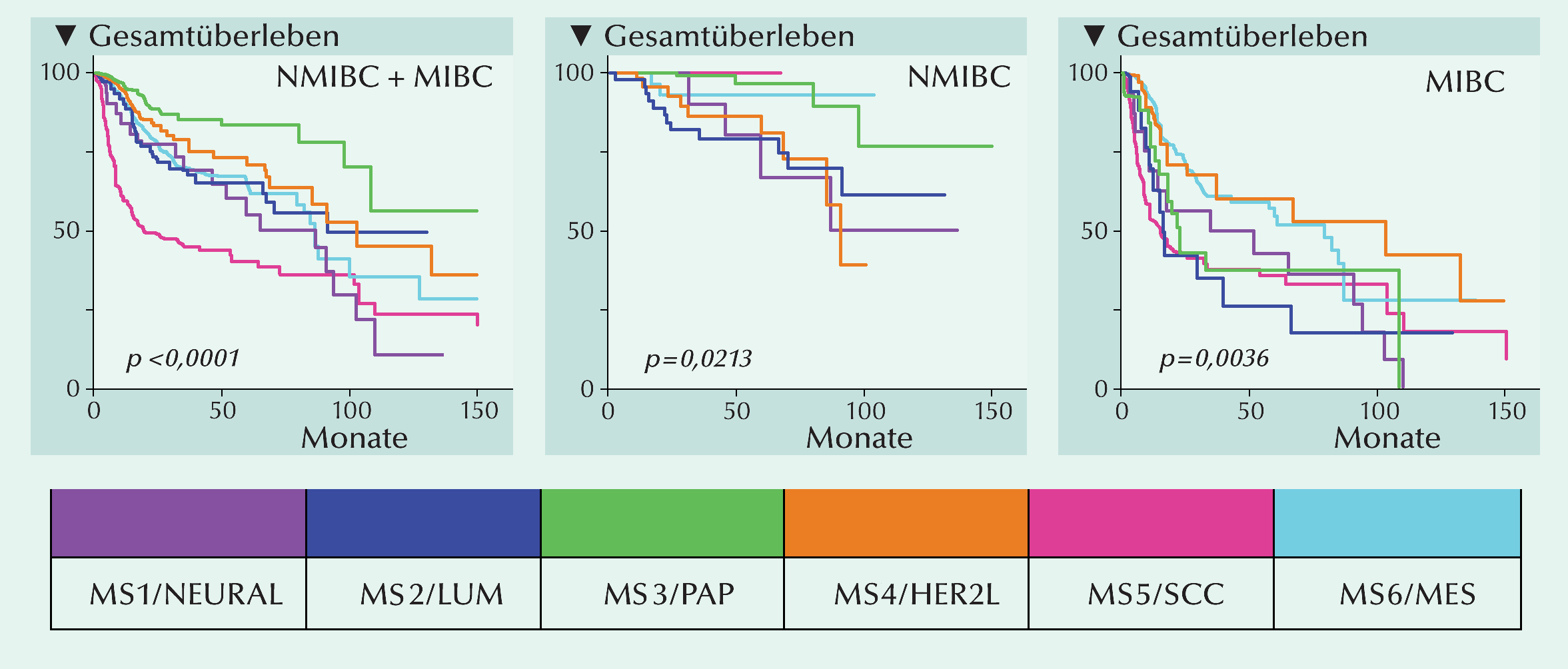
 Anhand einer Clusteranalyse wurden in der Meta-Kohorte sechs molekulare Subtypen identifiziert:
NEURAL (neuralartig), LUM (luminal), PAP (papillär), HER2L (HER2-artig), MES (mesenchymartig),
SCC (einem Plattenepithelkarzinom gleichend). Sie werden als BOLD (bladder carcinoma subtype
of large meta-cohort database) bezeichnet.
In der gesamten Blasenkrebs-Kohorte wie auch gesondert nach NMIBC und NIBC ergaben sich mit BOLD
unterschiedliche mediane Gesamtüberlebensergebnisse
(p <0,0001; Abb.): PAP (>135 Mo), HER2L (107,7 Mo), NEURAL, LUM, MES (~90 Mo) und SCC (20,6 Mo).
Anhand einer Clusteranalyse wurden in der Meta-Kohorte sechs molekulare Subtypen identifiziert:
NEURAL (neuralartig), LUM (luminal), PAP (papillär), HER2L (HER2-artig), MES (mesenchymartig),
SCC (einem Plattenepithelkarzinom gleichend). Sie werden als BOLD (bladder carcinoma subtype
of large meta-cohort database) bezeichnet.
In der gesamten Blasenkrebs-Kohorte wie auch gesondert nach NMIBC und NIBC ergaben sich mit BOLD
unterschiedliche mediane Gesamtüberlebensergebnisse
(p <0,0001; Abb.): PAP (>135 Mo), HER2L (107,7 Mo), NEURAL, LUM, MES (~90 Mo) und SCC (20,6 Mo).
Bei Patienten mit NMIBC fanden sich die am deutlichsten ausgeprägten Unterschiede in der Überlebenserwartung zwischen PAP- und LUM-Tumoren. Es überrascht wohl nicht, dass das Transkriptom seltenerer aggressiver Blasenkrebs-Varianten mit nicht-urothelialer Histologie, dem mit ungünstiger Prognose behafteten Subtypen SCC, MES und HER2L ähnlich ist. Anhand der BOLD-Klassifizierung von Blasenkrebs lassen sich für die Behandlung bestimmte Vorgehensweisen ableiten. Insbesondere NMIBC-Patienten mit PAP-Subtyp haben signifikant günstige Überlebensergebnisse und müssten daher weniger häufig überwacht werden. Dagegen besteht bei HER2L, LUM, MES und SCC ein hohes Progressionsrisiko. Die Patienten sollten daher engmaschiger kontrolliert werden und benötigten eine aggressivere Behandlung. Eine erhöhte Expression von PD-1 und CTLA-4 bei NEURAL, MES und SCC macht sie prinzipiell zu Kandidaten für eine Behandlung mit PD-1/PD-L1- oder CTLA-4-Antagonisten. Doch bisherige Studiendaten lassen keine Assoziation mit komplettem Ansprechen bei Anti-PD-1/PD-L1-Therapie erkennen. Allerdings haben HER2L-Tumore eine hohe Mutations- und Neoantigenlast, die ein dauerhaftes Ansprechen auf Immune-Checkpoint-Inhibition erwarten lassen. Bei der Heterogenität von Blasenkrebs scheint vielfach eher eine mehrgleisige Therapie erfolgversprechend zu sein. Das zeigen z. B. MES und SCC, deren PD1- und CTLA-4-Signalwege zwar hochaktiv sind, die zugleich aber auch erhöhte Angiogenese, TGF-β-Signalfunktion und erhöhte Infiltration von immunsuppressiven Makrophagen M2 aufweisen. Letztere stehen mit ausbleibendem Ansprechen auf Immuntherapien in Verbindung. Als praktikable Behandlungsoptionen empfehlen sich stattdessen Kombinationen eines Immun-Checkpoint-Inhibitors mit einem Inhibitor der Rezeptor-Tyrosinkinase AXL bei MES-Tumoren, einem Anti-TGF-β-Antikörper bei MES- und SCC-Tumoren oder einem Androgenrezeptor (AR)-Inhibitor in MES- und SCC-Tumoren.
Mögliche weitere Subtyp-spezifische Therapieziele könnten bei PAP-Tumoren die Fibrobblastenrezeptor-3
(FGFR3)-Achse, bei HER2L- und LUM-Tumoren die ERBB2-Amplifikation und in NEURAL-, MES- und SCC-Tumoren
die COX2-befeuerte Wundheilungsreaktion sein.
Tan TZ, Rouanne M, Tan KT et al. 2018. Molecular subtypes of urothelial bladder cancer: results from a meta-cohort analysis of 2411 tumors. Eur Urol https://doi.org/10.1016/j.eururo.2018.08.027 [Epub ahead of print]. |
|||
| ||||