Nierenzellkarzinom (NZK): |
|||||||||||||||
 Die Immuntherapie mit Checkpoint-Inhibitoren hat sich beim NZK als wirksam erwiesen und ist
für Patienten im fortgeschrittenen Krankheitsstadium bereits zugelassen. In der gegenwärtig noch
laufenden KEYNOTE-427-Studie wird Pembrolizumab als Monotherapie beim fortgeschrittenen Nierenzellkarzinom
in der Erstlinienbehandlung geprüft. Nach der Tumor-Histologie war eine Kohorte A aus Patienten
mit klarzelligem NZK und eine Kohorte B aus Patienten mit nicht klarzelligem NZK gebildet worden.
Auf dem ASCO 2018 in Chicago und dem ESMO 2018 Congress in München wurden Daten aus der Kohorte A präsentiert.
Die Immuntherapie mit Checkpoint-Inhibitoren hat sich beim NZK als wirksam erwiesen und ist
für Patienten im fortgeschrittenen Krankheitsstadium bereits zugelassen. In der gegenwärtig noch
laufenden KEYNOTE-427-Studie wird Pembrolizumab als Monotherapie beim fortgeschrittenen Nierenzellkarzinom
in der Erstlinienbehandlung geprüft. Nach der Tumor-Histologie war eine Kohorte A aus Patienten
mit klarzelligem NZK und eine Kohorte B aus Patienten mit nicht klarzelligem NZK gebildet worden.
Auf dem ASCO 2018 in Chicago und dem ESMO 2018 Congress in München wurden Daten aus der Kohorte A präsentiert.
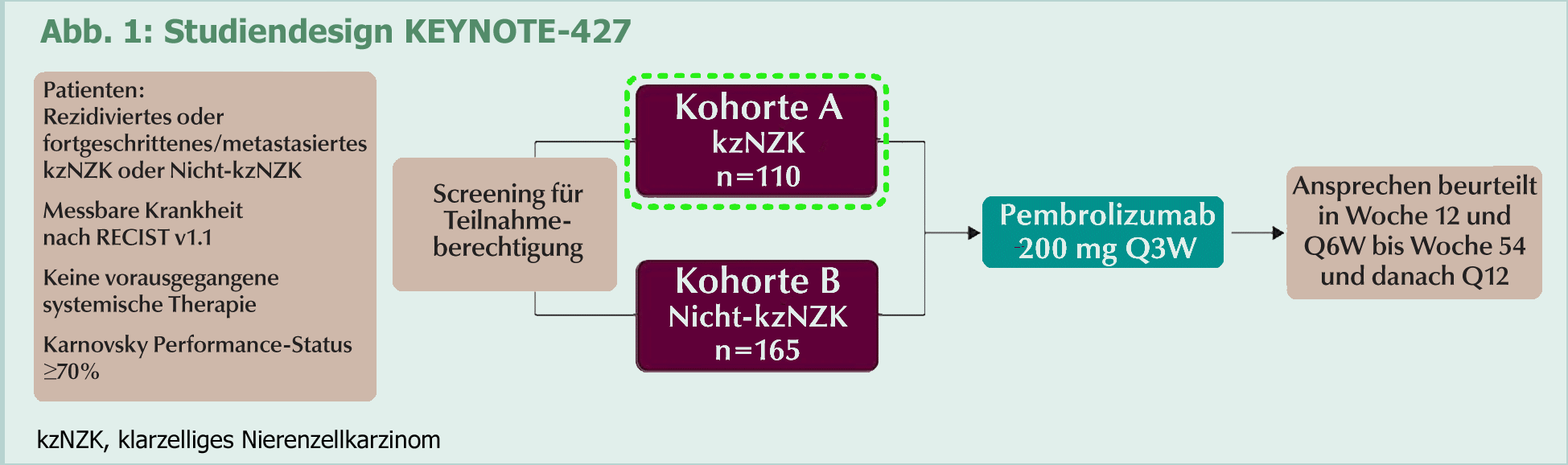
 In KEYNOTE-427, einer einarmigen Open-label-Studie der Phase II, sollten mit zwei Kohorten
Wirksamkeit und Sicherheit von Pembrolizumab als Erstlinien-Monotherapie bei fortgeschrittenem
klarzelligem NZK und nicht klarzelligem NZK beurteilt werden.
In KEYNOTE-427, einer einarmigen Open-label-Studie der Phase II, sollten mit zwei Kohorten
Wirksamkeit und Sicherheit von Pembrolizumab als Erstlinien-Monotherapie bei fortgeschrittenem
klarzelligem NZK und nicht klarzelligem NZK beurteilt werden.
 Das Studiendesign von KEYNOTE-427 ist in Abbildung 1 dargestellt.
Das Studiendesign von KEYNOTE-427 ist in Abbildung 1 dargestellt.
 Zum Zeitpunkt des Daten-Cutoff (12. März 2018) betrug das mediane Follow-up 12,1 Monate.
Von 110 aufgenommenen Patienten (medianes Alter 64 Jahre, 78% Männer) entfielen
37,3%, 47,3% bzw. 15,5% in die IMDC-Risiko-Kategorien günstig, intermediär und ungünstig.
Bei 49 Patienten dauerte die Behandlung fort.
Zum Zeitpunkt des Daten-Cutoff (12. März 2018) betrug das mediane Follow-up 12,1 Monate.
Von 110 aufgenommenen Patienten (medianes Alter 64 Jahre, 78% Männer) entfielen
37,3%, 47,3% bzw. 15,5% in die IMDC-Risiko-Kategorien günstig, intermediär und ungünstig.
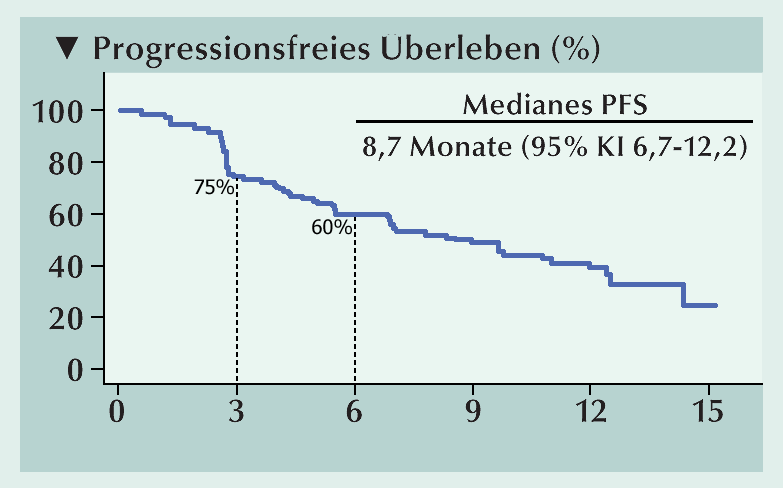
Bei 49 Patienten dauerte die Behandlung fort.Ein bestätigtes Ansprechen wurde bei 42 Patienten (38,2%) berichtet – darunter 3 komplette Ansprechen und 39 partielle Ansprechen. Die dauerhafte Krankheitskontrollrate (komplettes Ansprechen + partielles Ansprechen + ≥6 Monate stabile Krankheit) betrug 59,1% (n=65). Eine Verringerung der Tumorlast erfuhren 67,3% der Patienten. In 14,5% der Fälle betrug die Reduktion ≥80% und 7,3% der Patienten erreichten eine 100%ige Reduktion der Tumorlast. Das mediane progressionsfreie Überleben erreichte 8,7 Monate (Abb. 2). Die Gesamtüberlebensrate nach 6 Monaten betrug 93%. Das mediane Gesamtüberleben wurde noch nicht erreicht. Bezogen auf das Ansprechen nach dem International Metastatic Renal-Cell Carcinoma Database Consortium (IMDC)-Risiko, betrug die Krankheitskontrollrate bei günstigem Risiko 66% und in der Kohorte mit intermediärem/ungünstigem Risiko 55%. Die bestätigte objektive Ansprechrate war bei intermediärem/ungünstigem Risiko höher (42%) als bei günstigem Risiko (32%). Die von der ICD bestätigte objektive Ansprechrate nach RECIST v1.1. betrug 38%. Darunter waren drei Patienten mit komplettem Ansprechen. Mehrheitlich wurden partielles Ansprechen (35%) oder stabile Krankheit (32%) erreicht. Die Krankheitskontrollrate belief sich auf 59%.
Behandlungsbezogene Nebenwirkungen waren bei 73,6% der Patienten aufgetreten. Am häufigsten mit ≥10% Betroffener
waren Fatigue (23,6%), Pruritus (21,8%), Diarrhö (16,4%), Hautausschlag (12,7%)
und Arthralgie (11,8%). Bei 18,2% der Patienten traten therapieassoziierte Nebenwirkungen Grad 3-5 auf.
Ein Patient hatte Grad-5-Pneumonitis.
10,9% der Patienten brachen die Therapie aufgrund von Therapie-assoziierten Nebenwirkungen ab.
Hoch dosiertes Steroid wurde 12,7% der Patienten appliziert. Das Sicherheitsprofil entsprach
weitgehend dem von Pembrolizumab bei anderen Tumorentitäten.
McDermott DF, Lee J-L, Szczylik C, et al. 2018. Pembrolizumab monotherapy as first-line therapy in advanced clear cell renal cell carcinoma (accRCC): Results from cohort A of KEYNOTE-427. J Clin Oncol 36(15_suppl):4500-4500. Donskov F, McDermott DF, Lee JL, et al. 2018. KEYNOTE-427 cohort A: Pembrolizumab monotherapy as first-line therapy in advanced clear cell renal cell carcinoma (ccRCC) Ann Oncol 29 (suppl_8):viii303-viii331. 10.1093/annonc/mdy283 |
|||||||||||||||
| |||||||||||||||