Vor genau 25 Jahren wurde BOTOX® von Allergan mit dem Wirkstoff Botulinumtoxin Typ A zugelassen. Das Spektrum an Indikationen ist mittlerweile sehr breit. So ist BOTOX® das einzige Botulinumtoxin-Typ-A-Präparat, das eine Zulassung für die Therapie der Chronischen Migräne sowie zur Behandlung der idiopathisch überaktiven Blase aufweist [1]. Aber auch in vielen anderen Indikationen konnte sich das Botulinumtoxin Typ A einen festen Platz erobern. „Die Injektion von Botulinumtoxin Typ A gilt als Therapie der ersten Wahl bei essentiellem Blepharospasmus“, sagt die Neuro-Ophthalmologin Prof. Dr. Bettina Wabbels beispielsweise über die Indikation Lidkrampf, für die BOTOX® als erstes zugelassen wurde. Von seiner Erfolgsgeschichte zeugt, dass der Name „Botox“ für viele ein Synonym für Botulinumtoxine schlechthin geworden ist, obwohl es keine Abkürzung für Botulinumtoxin-Produkte im Allgemeinen ist, sondern eine geschützte Marke des Unternehmens Allergan.
Botulinumtoxin ist ein vom Bakterium Clostridium botulinum produziertes Protein,
das die Erregungsübertragung an der neuromuskulären Synapse durch Blockade
der Acetylcholinausschüttung hemmt. Damit wirkt es muskelrelaxierend und
kann, in toxischen Dosen, zu Muskellähmungen führen. Gering dosiert kann
die muskelrelaxierende Wirkung bei einer ganzen Reihe von Erkrankungen
eingesetzt werden, an deren Pathogenese die Überaktivität von Muskeln
beteiligt ist [2]. Wie die aktuelle Forschung zeigt, erklärt sich die Wirkung
bei Chronischer Migräne wahrscheinlich aus der zusätzlichen „neuromodulatorischen"
Wirkung auf sensorische Neurotransmitter [1,3]
Wie aus dem Bakterium ein Medikament wurde
Die lange Karriere von Botulinumtoxin begann nicht als Heilmittel, sondern
mit verdorbenem Fleisch. Zur Erklärung der von ihm untersuchten Fälle von
Fleischvergiftung vermutete der süddeutsche Arzt Justinus Kerner Anfang
des 19. Jahrhunderts die Existenz einer „Fettsäure“, die für die
Vergiftungserscheinungen verantwortlich war. Um 1896 gelang schließlich
die Isolierung des Bakteriums Clostridium botulinum und später die
Charakterisierung des von ihm produzierten Proteins Botulinumtoxin [4].
Dessen therapeutisches Potential wurde jedoch erst in den 1970er Jahren
erschlossen und führte zur FDA-Zulassung von BOTOX® im Jahr 1989 [4].
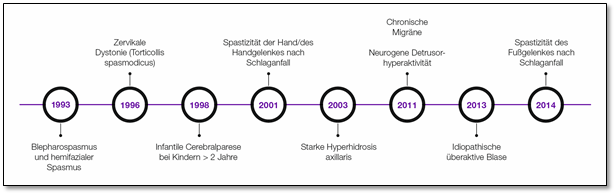
Vor 25 Jahren, im Jahr 1993, erfolgte schließlich auch die Zulassung in
Deutschland. War BOTOX® zunächst nur zur Behandlung des Blepharospasmus
und des hemifazialen Spasmus zugelassen, führten die Zulassungserweiterungen
der folgenden Jahre zu der großen Vielfalt von Indikationen, in denen
BOTOX® heute eingesetzt werden kann:
• 1993 Hemifazialer Spasmus & Blepharospasmus
• 1996 Zervikale Dystonie
• 1998 Juvenile Zerebralparese bei Kindern >2 Jahren
• 2001 Spastik der Hand / des Handgelenkes nach Schlaganfall
• 2003 Starke Hyperhidrosis axillaris
• 2011 Chronische Migräne & neurogene Detrusorhyperaktivität
• 2013 Idiopathische überaktive Blase
• 2014 Spastik des Fußgelenkes nach Schlaganfall
Die Wirksamkeit von BOTOX® bei Chronischer Migräne ist von besonderem Interesse,
da diese Erkrankung ein großes Problem für das Gesundheitssystem darstellt [5].
„Insgesamt ist durch unbehandelte Chronische Migräne von erheblichen
Gesundheitskosten auszugehen“, bestätigt auch Prof. Dr. Andreas Straube,
Neurologe an der Universität München, Klinikum Großhadern. BOTOX® kann bei
Patienten mit Chronischer Migräne eingesetzt werden, die auf prophylaktische
Medikation nur unzureichend angesprochen oder diese nicht vertragen haben.
Zur Behandlung wird das Präparat nach einem standardisierten Schema etwa
alle 12 Wochen in festgelegte Muskeln im Stirn- und Nackenbereich injiziiert [1,6].
Wie in Studien gezeigt wurde, kann eine solche Behandlung mit BOTOX®
die Zahl der Migränetage bei den Patienten im Vergleich zu Placebo
signifikant verringern. So erreichen mehr als 70 % der Patienten nach
dem dritten Injektionszyklus eine Reduktion der Kopfschmerztage um mindestens
die Hälfte [7,8].
Neben der Zulassung für die Chronische Migräne stellt die Zulassung von
BOTOX® zur Behandlung der idiopathischen überaktiven Blase und der
neurogenen Detrusorhyperaktivität in Folge einer Rückenmarksverletzung
oder von Multipler Sklerose ein Alleinstellungsmerkmal dar [1]. Die
Behandlung erfolgt hier direkt durch Injektion in die Blasenwand,
wodurch es zur Entspannung des überaktiven Detrusormuskels und zu
einer deutlichen Verbesserung der Symptome kommt [9,10].
Botulinumtoxin Typ A wird in einem patentierten Herstellungsprozess aus Kulturen von Clostridium botulinum gewonnen. Zur behördlich vorgeschriebenen Feststellung der Produktsicherheit und der Wirkstärke war bis vor einiger Zeit der LD50-Test an Mäusen Standard. Das Unternehmen Allergan investierte mehr als 65 Millionen US-Dollar und über zehn Jahre intensiver Forschung, um diese Tierversuche durch zellbasierte Tests zu ersetzen. Für Allergans Botulinumtoxin-Typ-A-Produkte wird seitdem ein validierter und zugelassener, zellbasierter Alternativtest ohne Tierversuche verwendet. Dieser Test wird eingesetzt, um BOTOX®-Chargen freizugeben, die in der Europäischen Union sowie einer Reihe weiterer Länder verkauft werden, darunter USA, Kanada und Australien. Dies ist nur ein Beispiel für die kontinuierliche Forschungsaktivität von Allergan, die das Ziel hat, BOTOX® weiter zu verbessern und seine therapeutischen Möglichkeiten zum Wohle der Patienten auch nach 25 Jahren weiter zu entwickeln.
Allergan Deutschland, Frankfurt am Main, www.Allergan.de
Quellen:
[1] Fachinformation Botox, Stand: Oktober 2018.
[2] Dolly JO, Aoki KR. Eur J Neurol 2006;13 (Suppl. 4):1–9.
[3] Cernuda-Morollón E et al. Pain 2015;156:820–4.
[4] Sommer B. Botulinumtoxin in der ästhetischen Medizin (2 Aufl.). Stuttgart: Thieme, 2003.
[5] Bloudek LM et al. J Headache Pain 2012;13:361–78.
[6] Blumenfeld AM et al. Headache 2017;57:766-77.
[7] Dodick DW et al. Headache 2010;50(6):921-36.
[8] Silberstein SD et al. J Neurol Neurosurg Psychiatry 2015; 86:996-1001.
[9] Nitti VW et al. J Urol 2013; 189:2186-93.
[10] Rovner E et al. Neurourol Urodyn 2013; 32(8):1109-15.
| Dezember 2018 |
Warning: include(../cols3/aa_meldungen.php): failed to open stream: No such file or directory in /var/www/web383/html/uros/meldungen/aa_2018_botox.php on line 185
Warning: include(../cols3/aa_meldungen.php): failed to open stream: No such file or directory in /var/www/web383/html/uros/meldungen/aa_2018_botox.php on line 185
Warning: include(): Failed opening '../cols3/aa_meldungen.php' for inclusion (include_path='.:/opt/php/5.4.45/share/pear:/usr/share/pear') in /var/www/web383/html/uros/meldungen/aa_2018_botox.php on line 185
© 2003-2024 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz