Prostatakrebs-Progression
Verbindung zwischen Androgenrezeptor und c-Myc
Die Mortalität von Prostatakrebs ist weitestgehend auf metastasierten, kastrationsresistenten Prostatakrebs (mCRPC) zurückzuführen, der trotz Androgendeprivationstherapie (ADT) progredient geworden ist. Vielfach überdauern Androgene im Tumorgewebe trotz kaum noch nachzuweisender Serum-
Anhand von Experimenten mit drei Prostatakrebszelllinien – den seit 1977 etablierten LNCaP-Zellen, Abl-Zellen, einem CRPC-Derivat der LNCaP-Zellen und den neuen 22RV1-Zellen – wurde untersucht, ob c-Myc ein direktes AR-Zielgen ist, und ob Androgenliganden für die Steuerung der c-Myc-
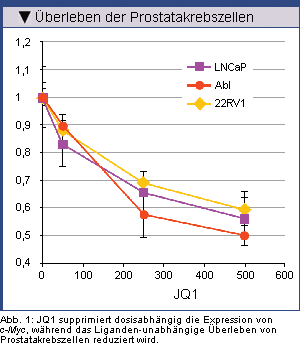
Obwohl AR die Expression von c-Myc erhöht, hatte die zusätzliche Behandlung mit dem potenten synthetischen
Androgen R1881 keinen weiteren Effekt. Es wurde auch keine vermehrte Besetzung des c-Myc-Enhancers mit AR
mittels Chromatin-Immunprezipitation (ChIP) Assays festgestellt. Das steht im Gegensatz zur parallel
analysierten, Androgen-
Der BET-Bromodomänen-Inhibitor JQ1 supprimiert die Expression und Funktion von c-Myc. Bei den Prostatakrebszellen
war das Liganden-
Gegenwärtig kommen Therapien wie Anti-Sense-
Die Ergebnisse lassen das Potenzial von Therapien, die gegen den AR in Prostatakrebszellen und gegen c-Myc gerichtet sind,
erkennen. Solche Behandlungsstrategien könnten die Androgendeprivationstherapie sinnvoll ergänzen.
Abb. 2: Bei der Prostatakrebsprogression sind der Androgenrezeptor (AR) und c-Myc ausschlaggebende Triebkräfte
Liganden-unabhängiger Mechanismen:
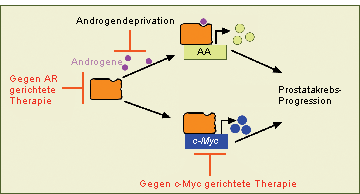
Androgene binden an den AR, der dann die Transkription Androgen-abhängiger
AR-Zielgene (AA) induziert. Aber auch wenn Androgene eliminiert werden, unterstützt der AR die Expression
Liganden-unabhängiger Zielgene wie c-Myc. Das c-Myc-Gen ist gewöhnlich in Prostatakarzinomen hochreguliert
und trägt zur Androgen-unabhängigen Krankheitsprogression bei. (rot: Therapiemöglichkeiten) Gegenwärtig ist
die Androgendeprivation die primäre medikamentöse Behandlung bei Prostatakrebs. Sie könnte durch Therapien,
die gegen den AR und c-Myc gerichtet sind, sinnvoll ergänzt werden.
![]() Gao L, Schwartzman J, Gibbs A, et al. 2013.
Androgen receptor promotes ligand-independent prostate cancer progression through c-myc upregulation. PLOS 8:e63563.
Gao L, Schwartzman J, Gibbs A, et al. 2013.
Androgen receptor promotes ligand-independent prostate cancer progression through c-myc upregulation. PLOS 8:e63563.
September 2013
red.