
![]()
Hintergrund
 In allen Gewebeproben wurden Proteine (TSPO und STAR) exprimiert, die durch ihre Funktion, Cholesterin
zur inneren Membran von Mitochondrien zu transportieren, auf das Potenzial zur De-novo-Synthese von
Steroidhormonen hindeuten. Ferner wird durchweg Cholesterin-Monooxygenase (CYP11A1) exprimiert, mit deren Hilfe
aus Cholesterin durch Spaltung der Seitenkette das Pregnenolon entsteht.
In allen Gewebeproben wurden Proteine (TSPO und STAR) exprimiert, die durch ihre Funktion, Cholesterin
zur inneren Membran von Mitochondrien zu transportieren, auf das Potenzial zur De-novo-Synthese von
Steroidhormonen hindeuten. Ferner wird durchweg Cholesterin-Monooxygenase (CYP11A1) exprimiert, mit deren Hilfe
aus Cholesterin durch Spaltung der Seitenkette das Pregnenolon entsteht.
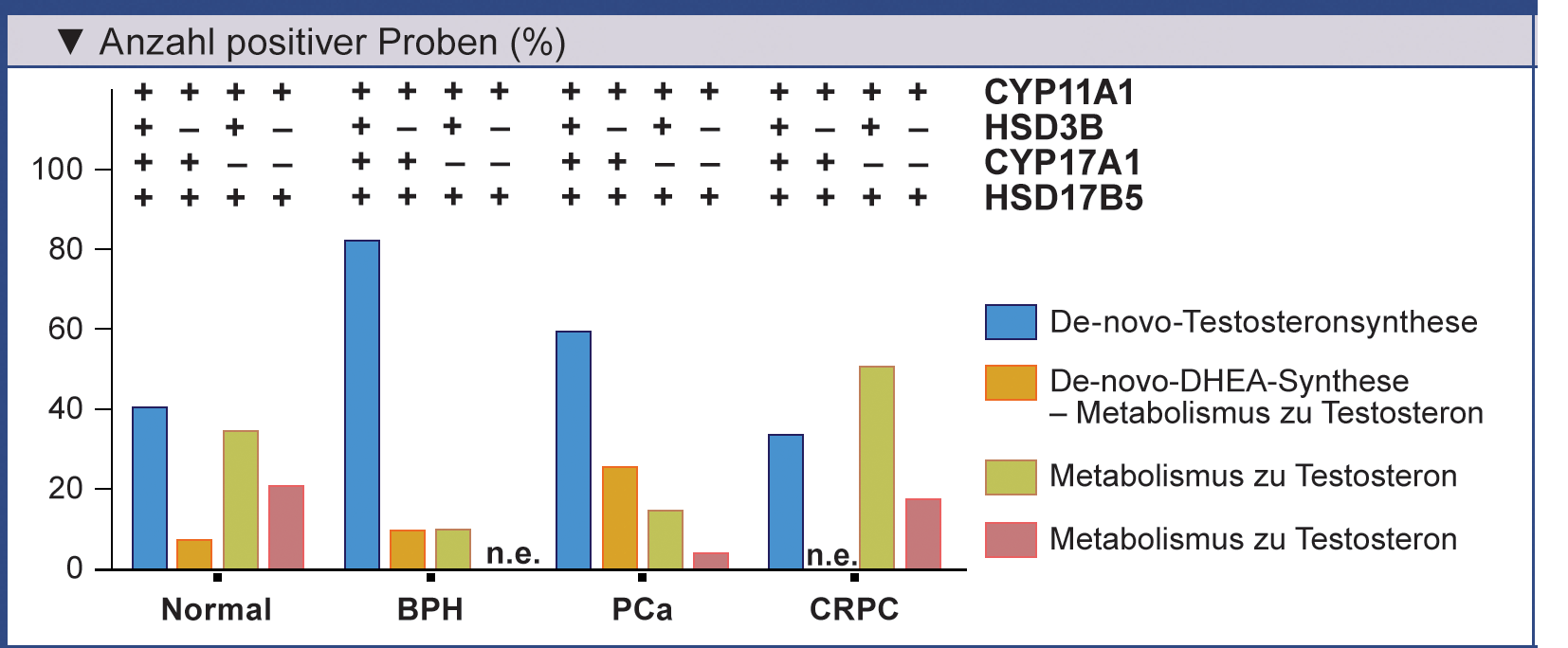
Die jeweilige Rate an Proben in denen die Schlüsselenzyme der Androgensynthese (CYP11A1, HSD3B1/2,
CYP17A1 und HSD17B5) exprimiert waren, geht aus der Abbildung hervor.
Danach hatte jeweils eine Mehrheit der Gewebeproben aus normaler Prostata, BPH und PCa das notwendige
Enzymrepertoire zur De-novo-Synthese von Testosteron (Abb.). Daraus lässt sich allerdings
nicht entnehmen, inwieweit eine De-novo-Synthese von Androgenen in den verschiedenen Gewebetypen der Prostata
klinisch relevant sein kann.
Bei Fehlen von HSD3B ist zwar die De-novo-Synthese von DHEA möglich, das dann aber nicht in Testosteron überführt werden kann.
Auch ohne HSD3B und/oder CYP17A1 können adrenale Androgene in der Prostata in Testosteron umgewandelt werden.
Sakai M, Martinez-Arguelles DB, Aprikian AG, et al. 2016. De novo steroid biosynthesis in human prostate cell lines and biopsies. Prostate 76:575-587.
| Oktober 2016 | Autor: jfs |