
Urothelkarzinom
Gesamtüberlebensvorteil mit Immuntherapie plus Chemotherapie
Die Cisplatin-basierte Chemotherapie ist der Erstlinienstandard beim nicht resektablen oder metastasierten Urothelkarzinom. Bis die Studienergebnisse von EV-302/KEYNOTE-A39 auf ESMO präsentiert wurden, hat keine additive Substanz das Gesamtüberleben (OS) verbessert, wenn sie gleichzeitig zu einer platinbasierten Chemotherapie in der Erstlinienbehandlung von inoperablem oder metastasiertem Urothelkarzinom hinzugefügt wird.
In der randomisierten Phase-III-Studie CheckMate 901 wurde Nivolumab in Kombination mit Gemcitabin/Cisplatin gegen die alleinige Chemotherapie geprüft. Die finalen Ergebnisse wurden ebenfalls beim ESMO präsentiert.
Insgesamt 608 Cisplatin-geeignete Patienten mit nicht behandeltem, nicht resektablem oder metastasiertem Urothelkarzinom erhielten im experimentellen Arm Nivolumab (360 mg, d1, q3w) plus Gemcitabin/Cisplatin für bis zu 6 Zyklen, gefolgt von einer Nivolumab-Monotherapie (480 mg, q4w) über die Dauer von maximal 24 Monaten oder im Kontrollarm Gemcitabin/ Cisplatin, q3w, für bis zu 6 Zyklen. Primäre Endpunkte waren das Gesamtüberleben (OS) und das progressionsfreie Überleben (PFS). Die mediane Nachbeobachtungszeit lag bei 33,6 Monaten.
Die eingeschlossenen Patienten waren median 65 Jahre alt, 21% von ihnen wiesen Lebermetastasen auf. Eine PD-L1-Expression des Tumors ≥1% wurde bei 36-37% der Patienten nachgewiesen. Im Median wurde die Studienmedikation über 7,4 Monate (Spanne: 0-47,9) im experimentellen und 3,7 Monate (0-14,3) im Kontrollarm gegeben. 74% versus 55% der Patienten komplettierten 6 Therapiezyklen gemäß Protokoll. Insgesamt erhielten 244 Patienten (80%), die randomisiert Nivolumab + Gemcitabin/Cisplatin zugeteilt wurden, eine Erhaltungstherapie mit Nivolumab als Monotherapie. Zum Zeitpunkt der Datenauswertung hatten 8% die Monotherapie abgeschlossen und 9% der Patienten befanden sich noch in Therapie.
|
|
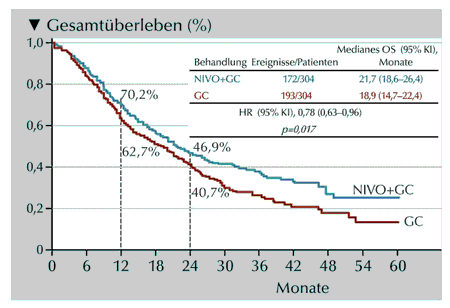
Abb.: Gesamtüberleben (OS) unter Therapie mit Nivolumab mit Chemotherapie (Gemcitabin plus Cisplatin)
oder Chemotherapie alleine (mod. nach Van der Heijden).
|
Die Studie erreichte ihren primären Endpunkt: Das mediane OS wurde mit der zusätzlichen Gabe von Nivolumab um fast drei Monate verbessert 21,7 gegenüber 18,9 Monaten (HR: 0,78, 95%-KI: 0,63–0,96, p=0,017)
Das mediane PFS war in beiden Studienarmen vergleichbar (7,9 vs. 7,6 Monate). Nach 12 und 24 Monaten zeigte sich aber die klare Separierung der Kaplan-Meier-Kurven mit PFS-Raten von 34,2% versus 21,8% bzw. 23,5% versus 9,6% (HR=0,72; 95% KI 0,59-0,88; p=0,0012).
Die Ansprechrate lag bei 57,6% mit Nivolumab versus 43,1% ohne Nivolumab und die Rate an Komplettremissionen bei 21,7% versus 11,8%. Die Dauer des Ansprechens war länger unter der Nivolumab-haltigen Therapie und erreichte bei kompletter Remission einen Median von 37,1 Monaten (vs. 13,2 Monate im Kontrollarm).
Die mit dem EORTC QLQ-C30 erhobene Lebensqualität war mit der zusätzlichen Nivolumab-Gabe erhalten geblieben. Es wurde zwischen
den Therapiearmen kein Unterschied festgestellt.
❏ Die objektive und vollständige Ansprechrate war unter Nivolumab + Gemcitabin/Cisplatin deutlich höher, die Kombination war mit einem tiefen und dauerhaften Ansprechen verbunden.
❏ Die Kombination von Immuncheckpoint-Inhibitor plus Chemotherapie konnte als Erstlinientherapie das Gesamtüberleben bei Patienten mit nicht resektablem oder metastasiertem Urothelkarzinom verlängern.
Van der Heijden MS, et al. 2023.
Nivolumab plus gemcitabine-cisplatin versus gemcitabine-cisplatin alone for previously untreated
unresectable or metastatic urothelial carcinoma: Results from the phase III CheckMate 901 trial. ESMO 2023, Abstr. #LBA7
![]() Dez. 2023
Red.
Dez. 2023
Red.![]()
© 2003-2024 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz