
erektion — ejakulation — penis — hoden — endokrinologie — fertilität — genetische aspekte — aging male — varia

Testosteronmangel und Adipositas als Wegbereiter von Insulinresistenz
Diabetes mellitus – insbesondere als Typ 2 und in Verbindung mit dem metabolischen Syndrom – stellt in zunehmendem Maße auch
für den Urologen ein Problem dar. Die Zahl der Patienten mit Störungen des Glukose- und Insulinstoffwechsels, bei denen zugleich
eine erektile Dysfunktion besteht, die unter den Symptomen eines Hypogonadismus leiden, oder bei denen weitere urologische
Komplikationen auftreten, steigt ständig. Insulinresistenz ist ein wesentliches Merkmal des Diabetes mellitus Typ 2. Sie geht
dem manifesten Diabetes vielfach um Jahre voraus und hat ihre Ursachen vor allem in Übergewicht und Bewegungsmangel. Andererseits
steht Adipositas – insbesondere viszerale Adipositas – bei Männern signifikant in Verbindung mit einem niedrigen Serum-Testosteronspiegel
und Insulinresistenz. Die damit verbundene inverse Beziehung zwischen Testosteron und Insulinresistenz wird höchstwahrscheinlich
durch das Körperfett vermittelt. Bei einer Veränderung der Körperzusammensetzung in Verbindung mit einer Gewichtsreduktion können
die Insulinresistenz und die Blutzuckerkontrolle positiv beeinflusst werden. Bei hypogonadalen Patienten ist der Testosteronausgleich
hierfür unabdingbare Voraussetzung.
-
Aus Befunden über Zusammenhänge zwischen Diabetes mellitus Typ 2 und endogenen Sexualhormonen lässt sich auf eine geschlechtsspezifische
Ätiologie von Störungen des Glukose- und Insulinstoffwechsels schließen. Das zeigt sich auch darin, dass Männer häufiger betroffen sind
als Frauen. Diesbezüglich kommt insbesondere dem Serum-Testosteron und dem Sexualhormon-bindenden Globulin (SHBG) eine Rolle zu. So besteht
bei Männern eine signifikante Verbindung zwischen einem niedrigen Serum-Testosteronspiegel, Insulinresistenz und Adipositas [1, 2].
-
Viszerales Fettgewebe ist metabolisch höchst aktiv. Via Portalkreislauf fluten in der Leber freie Fettsäuren an, durch die die hepatische
Insulinbindung und -aufnahme herabgesetzt, die Glukoneogenese stimuliert und die Insulinresistenz erhöht wird. In der Folge nehmen der
Insulinspiegel und die Insulinresistenz systemisch zu [2].
Tchernof et al. (1995) fanden Indizien dafür, dass bei Männern die Beziehung zwischen Androgenspiegeln und plasmatischen Indices der
Glukose-
Im Gegensatz zur Insulinresistenz scheint beim Diabetes ein direkter Zusammenhang mit niedrigen Spiegeln an Testosteron zu bestehen.
Svartberg et al. (2004) bestimmten im Rahmen der Tromsø-Studie bei 1 419 Männern die Spiegel an Gesamttestosteron und SHBG im Serum sowie
die Konzentration an glykosyliertem Hämoglobin (HbA1C). Hierbei ergab sich zwar eine signifikante Korrelation zwischen einer erhöhten
Konzentration an HbA1C wie auch dem Vorliegen eines Diabetes und niedrigen Spiegeln sowohl an Testosteron als auch an SHBG, doch dieser
Zusammenhang war unabhängig von den Kovariaten Adipositas und Körperfettverteilung [5].
-
Ding et al. publizierten 2006 einen systematischen Review und Metaanalysen aus 43 Querschnitts- und prospektiven Studien
zum Zusammenhang zwischen endogenen Sexualhormonspiegeln und dem Risiko für Diabetes mellitus Typ 2 bei beiden Geschlechtern.
In Querschnittsstudien lagen die Serum-Testosteronspiegel bei Männern mit Diabetes Typ 2 im Mittel um ca. 0,77 ng/ml niedriger
als bei den Kontrollen. Im Gegensatz dazu hatten Diabetikerinnen leicht erhöhte Testosteronspiegel. Aus den prospektiven Studien
geht hervor, dass bei Männern mit höheren Testosteronspiegeln (4,49 bis 6,05 ng/ml), das Risiko einen Diabetes mellitus Typ 2 zu
entwickeln um 42% niedriger war als bei Männern mit einem niedrigen Testosteronspiegel (Bereich: 2,13 bis 4,47 ng/ml). Auch
diesbezüglich bestand trendmäßig bei Frauen eine umgekehrte Beziehung [6].
In einer aktuellen australischen Studie hatten 43% der Männer mit einem Diabetes mellitus Typ 2 einen Spiegel an Gesamttestosteron unter 10 nmol/l und 57% einen Spiegel an berechnetem freien Testosteron unter 0,23 nmol/l. Bei Männern mit einem Diabetes mellitus Typ 1 waren 20% anhand ihrer Spiegel an freiem Testosteron als hypogonadal einzustufen. Alterskorrigiert entspricht das etwa der Rate bei Typ-2-Diabetikern. Bei beiden Formen von Diabetes mellitus waren die Spiegel an freiem Testosteron unabhängig mit der Insulinresistenz – berechnet nach der Formel für das Homeostatic Model Assessment for Insulin Resistance (HOMA-IR) – korreliert. Bei Typ-2-Diabetikern traf das auch für Gesamttestosteron zu [7].
In derselben Studie wurde bei einer Untergruppe der Typ-2-Diabetiker auch gezeigt, dass sich der Testosteronspiegel innerhalb
eines halben Jahres erhöht, wenn sich durch therapeutische Intervention und/oder einen veränderten Lebensstil die Insulinresistenz
bessert.
-
Von einem klinischen Hypogonadismus ist auszugehen, wenn sowohl ein Testosterondefizit festgestellt wurde, als auch diesbezügliche Symptome wie
Sexualstörungen, Müdigkeit, Vitalitätsverlust, unerklärliche körperliche Leistungseinbußen und eine veränderte Stimmungslage vorliegen.
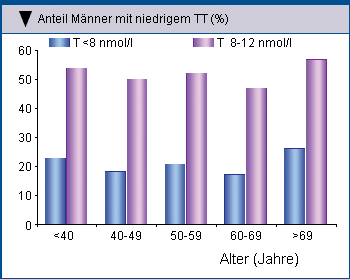
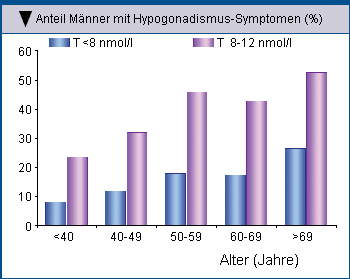
In einer Querschnittsstudie mit 355 Typ-2-Diabetikern wiesen 17 % der Männer einen Spiegel an Gesamttestosteron <8 nmol/l auf und litten an
typischen Symptomen eines Testosteronmangels. Als grenzwertig hypogonadal wurden Patienten eingestuft, wenn Symptome bei einem Spiegel an
Gesamttestosteron zwischen 8 und 12 nmol/l auftraten. Der Anteil der Typ-2-Diabetiker mit niedrigen Testosteronspiegeln in verschiedenen
Altersdekaden war zwar ziemlich konstant (Abb. 1), doch mit zunehmendem Alter stellte sich vermehrt ein manifester Hypogonadismus ein (Abb. 2) [8]
.
|
|
| Abb. 1: Anteil der Typ-2-Diabetiker mit niedrigem(<8 nmol/l) und grenzwertig niedrigem (8 – 12 nmol/l) Gesamttestosteronspiegel (TT) nach Altersdekaden (Kapoor D, et al. 2007). | Abb. 1: Anteil der Typ-2-Diabetiker mit niedrigem (< 8 nmol/l) und grenzwertig niedrigem (8 – 12 nmol/l) Gesamttestosteronspiegel (TT) bei denen Symptome eines Testosteronmangels auftraten nach Altersdekaden (Kapoor D, et al. 2007). |
-
Unter den zahlreichen Risikofaktoren für eine erektile Dysfunktion (ED) wie Alter, Hypertonie, Fettstoffwechselstörungen, Adipositas, koronare
Herzerkrankungen, LUTS, Rauchen und Diabetes mellitus ist letzterer einer der gewichtigsten. Das Risiko steigt „exponentiell“ mit Fortdauer der
Krankheit, einer unzureichenden Blutzuckerkontrolle und weiteren neurologischen Komplikationen. Nach Daten der Massachusetts Male Aging Study
ist die Prävalenz von Erektionsstörungen bei Diabetikern etwa doppelt so hoch wie in der restlichen männlichen Bevölkerung [9]. Neben einer ED
können gegebenenfalls auch eine verminderte Libido, Orgasmusstörungen und retrograde Ejakulationen mit Diabetes im Zusammenhang stehen.
Trotz der erstaunlichen Behandlungserfolge bei ED mit modernen Phosphodiesterase-5 (PDE5)-Inhibitoren gelten Diabetiker mit ED nach wie vor als Problempatienten. Bei Männern mit ungeklärter, schwer therapierbarer ED ergibt sich unter Umständen der Verdacht auf einen bislang nicht diagnostizierten Diabetes mellitus.
Die Untersuchungsergebnisse bei Diabetikern deuten überwiegend darauf hin, dass durch die Degeneration nitrerger Nerven im Penis die NO-vermittelte
Relaxation der kavernösen glatten Muskelzellen verhindert wird. Noch nicht geklärt ist, ob Mikroangiopathien die erektile Funktion direkt oder über
die Verursachung von Neuropathien beeinträchtigen.
-
Bei Ausgleich eines Testosteronmangels wird ein endokrines Milieu geschaffen, das die Reduktion des Körperfetts begünstigt.
Entsprechend wurden in verschiedenen kleinen Studien günstige Effekte einer Substitutionstherapie bei adipösen Männern mit
niedrigem Spiegel an Gesamttestosteron auf die Insulinsensitivität beobachtet [10, 11].
In einer Placebo-kontrollierten Crossover-Studie ermittelten Kapoor D, et al. (2006), dass es durch Testosteronausgleich bei
hypogonadalen Typ-2-Diabetikern zu verminderter Insulinresistenz (gemessen anhand des Surrogat-Parameters HOMA) und niedrigeren
Blutzuckerwerten kommt. Zugleich wurden verringerte Spiegel an Gesamtcholesterin gemessen und die Abnahme viszeralen Fettgewebes
anhand der Abnahme des Bauchumfanges registriert. Insgesamt kann somit von einer Reduktion des kardiovaskulären Risikos ausgeganden
werden [12].
Basu et al. (2007) behandelten ältere Männer mit relativem Testosteronmangel zwei Jahre lang mit einem Testosteronpflaster (5 mg/d)
und fanden trotz Anhebung des Testosteronspiegels in den physiologischen Bereich keine Verbesserung der Glukosetoleranz oder
Veränderungen der Insulinsekretion, der Insulinwirkung, der Glukoseeffektivität, der hepatischen Insulinclearance und des postprandialen
Glukosemetabolismus [13].
In einer Praxisstudie registrierte Heufelder A (2009) bei Typ-2-Diabetikern mit niedrigem freiem Testosteron Verbesserungen der
Blutzucker- und Cholesterinwerte sowie eine niedrigere Konzentration an glykosyliertem Hämoglobin aufgrund von verhaltenstherapeutischen
Maßnahmen allein, die aber deutlich stärker ausgeprägt waren, wenn die Lebensstiländerung durch einen Testosteronausgleich begleitet wurde.
Der Münchener Endokrinologe kommt zu dem Schluss, dass die Kombination einer adäquaten Ernährungsweise, körperlicher Betätigung und
Widerstands-
-
Literatur:
[1] Rice D, Brannigan RE, Campbell RK, et al. 2008. Men´s health, low testosterone, and diabetes. Individualized treatment and a multidisciplinary approach. Diabetes Educ 34(Suppl 5):97S-112S.
[2] Kapoor D, Malkin CJ, Channer KS, Jones TH, 2005. Androgens, insulin resistance and vascular disease in men. Clin Endocrinol 63:236-250.
[3] Tchernof A, Despres JP, Dupont A, et al. 1995. Relation of steroid hormones to glucose tolerance and plasma insulin levels in men. Importance of visceral adipose tissue. Diabetes Care 18:292-299.
[4] Tsai EC, Matsumoto AM, FujimotoWY, Boyko EJ, 2004. Association of bioavailable, free, and total testosterone with insulin resistance. Influence of sex hormone–binding globulin and body fat. Diabetes Care 27:761-768.
[5] Svartberg J, Jenssen T, Sundsfjord J, Jorde R, 2007. The associations of endogenous testosterone and sex hormone-binding globulin with glycosylated hemoglobin levels, in community dwelling men. The Tromsø Study. Diabetes Metab 30:29-34.
[6] Ding EL, Song Y, Malik VS, Liu S, 2006. Sex differences of endogenous sex hormones and risk of type 2 diabetes. A systematic review and meta-analysis. JAMA 295:1288-1299.
[7] Grossmann M, Thomas MC, Panagiotopoulos S, et al. 2008. Low testosterone levels are common and associated with insulin resistance in men with diabetes. J Clin Endocrinol Metab 93:1834-1840.
[8] Kapoor D, Aldred H, Clark S, et al. 2007. Clinical and biochemical assessment of hypogonadism in men with type 2 diabetes. Diabetes Care 30:911-917.
[9] Johannes CB, Araujo AB, Feldman HA, et al. 2000. Incidence of erectile dysfunction in men 40 to 69 years old: longitudinal results from the Massachusetts Male Aging Study. J Urol 163:460-463.
[10] Simon D, Charles MA, Lahlou N, et al.2001. Androgen therapy improves insulin sensitivity and decreases leptin level in healthy adult men with low plasma total testosterone. Diabetes Care 24:2149–2151.
[11] Marin P, Holmang S, Jonsson L, et al. 1992. The effects of testosterone treatment on body composition and metabolism in middle-aged obese men. International Journal of Obesity and Related Metabolic Disorders 16:991–997.
[12] Kapoor D, Goodwin E, Channer KS, Jones TH, 2006. Testosterone replacement therapy improves insulin resistance, glycaemic control visceral adiposity, and hypercholesteolaemia in hypogonadal men with type 2 diabetes. Eur J Endocrinol 154:899-906.
[13] Basu R, Dalla Man C, Campioni M, et al. 2007. Effect of two years of testosterone replacement on insulin secretion, insulin-action, glucose effectiveness, hepatic insulin clearance, and postprandial glucose turnover in elderly men. Diabetes Care 30:1972-1978. [14] Heufelder A, 2008. Testosterone, the metabolic syndrome and diabetes mellitus J Men‘s Health 5: S11-S17.
© 2003-2024 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
