
erektion — ejakulation — penis — hoden — endokrinologie — fertilität — genetische aspekte — aging male — varia
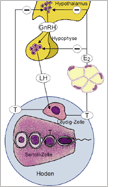
Bezüglich des negativen Feedback-Mechanismus auf der hypothalamisch-hypophysär-testikulären (HHT)-Achse durch Sexualsteroide bestehen
nach wie vor offene Fragen. Um zu klären, welche relativen Beiträge Testosteron und Estradiol zur Regulierung der Luteinisierungshormon
(LH)-Sekretion an welchem Ort leisten, wurden Hormonbestimmungen unter Verwendung eines Ablations- und Substitutionsmodells an gesunden
Männern und Patienten mit einem idiopathischen hypogonadotropen Hypogonadismus (IHH) vorgenommen (Pitteloud N, et al. 2008):
-
An den Untersuchungen beteiligten sich 22 endokrinologisch normale Männer und 11 Patienten mit einem IHH, verbunden mit einer
Gonadotropin-
Die Testosteron (T)- und Estradiol (E2)-Spiegel der Studienteilnehmer wurden mittels hoch dosiertem Ketokonazol auf Kastrationsniveau gebracht. Zugleich wurde durch Ketokonazol das Atomatase-Enzymsystem inhibiert.
Die prospektiven Untersuchungen erfolgten in drei Armen mit jeweils gesunden Männern und IHH-Patienten, an denen sich die Teilnehmer
z.T. mehrfach beteiligten (zeitlicher Abstand mindestens drei Monate):
Arm 1: (T-, E2-), kein Sexualsteroid-Add-back,
Arm 2: (T+, E2-), T-Add-back mit 125 mg Testosteronenanthat i.m. am 4. Tag,
Arm 3: (T-, E2+), E2-Add-back mit Estrogenpflastern 37,5 g/d vom 4. bis 7. Tag.
-
Sowohl bei den gesunden Probanden als auch bei den IHH-Patienten sanken die T-Spiegel in allen drei Armen an den Tagen 3 und 4 von physiologischen
Ausgangswerten auf Kastrationsniveau.
Bei den Personen in Arm 1 ohne Sexualsteroid-Add-back blieben die T- und E2-Spiegel über die siebentägige Studiendauer konstant supprimiert.
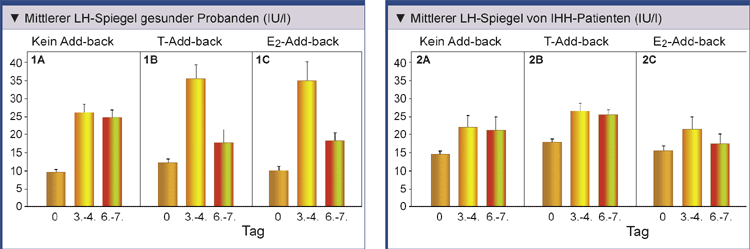
Der LH-Spiegel stieg bei den gesunden Probanden am 3. bis 4. Tag auf fast das Dreifache an und blieb bis zum 7. Tag nahezu auf dieser Höhe (Abb. 1A). Bei den IHH-Patienten stieg der LH-Spiegel ebenfalls an – allerdings nur um etwa 35% (Abb. 2A).
Die GnRH-Pulsfrequenz stieg bei den endokrinologisch gesunden Probanden von ausgangs 5,1 Pulsen in 12 h auf 10,6 und 14,3 Pulse in 12 h nach 3
bis 4 bzw. 6 bis 7 Tagen.
-
Nach Substitution von Testosteron blieb der E2-Spiegel deutlich unterhalb des Ausgangswertes, was auf die Aromatase-inhibierende Wirkung des
Ketokonazols zurückzuführen ist.
Der LH-Spiegel sank bei den gesunden Probanden auf ca. die Hälfte ab (Abb. 1B). Im Gegensatz dazu blieb er bei den IHH-Patienten nahezu konstant (Abb. 2B). Die Testosteronsubstitution war bei den gesunden Probanden von einer Anhebung der LH-Amplitude von 6,9 ±1,0 auf 12,1 ±14 zwischen den Tagen 4 bis 7 begleitet. Bei den IHH-Patienten wurde eine signifikante Erhöhung der LH-Amplitude unter Sexualsteroid-Ablation registriert, die auch nach Testosteron-Add-back bestehen blieb.
Die GnRH-Pulsfrequenz verringerte sich nach der Testosteronsubstitution auf den Ausgangswert und die LH-Pulsamplitude erhöhte sich. Bei den IHH-Patienten
kam es durch den Testosteron-Add-back zum Anstieg der LH-Pulsamplitude.
|
Abb. 1: Mittlere LH-Spiegel in drei Studienarmen mit gesunden männlichen Probanden vor und nach biochemischer Kastration für sieben Tage. (A) Kein Add-back von Sexualsteroiden, (B) Testosteron (T)-Add-back am Tag 4 und (C) Estradiol (E2)-Add-back an den Tagen 4 bis 7 (nach Pitteloud N, et al. 2008). |
Abb. 2: Mittlere LH-Spiegel in drei Studienarmen mit IHH-Patienten vor und nach biochemischer Kastration für sieben Tage. (A) Kein Add-back von Sexualsteroiden, (B) Testosteron (T)-Add-back am Tag 4 und (C) Estradiol (E2)-Add-back an den Tagen 4 bis 7 (nach Pitteloud N, et al. 2008). |
-
Nach Anlegen der Estradiolpflaster stellten sich sowohl bei den IHH-Patienten als auch bei den Kontrollprobanden normale Serum-Estradiolspiegel
ein. Bei letzteren erreichten die Spiegel allerdings ein signifikant höheres Niveau als bei der Eingangsuntersuchung.
Die GnRH-Pulsfrequenz verringerte sich nach der Estradiolsubstitution, blieb aber deutlich über dem Ausgangswert.
Nach der E2-Zufuhr sanken die LH-Spiegel (Abb. 1C), die GnRH-Pulsfrequenz und die LH-Pulsamplitude bei den gesunden Patienten signifikant ab, blieben aber deutlich über dem Ausgangsniveau.
Bei den IHH-Patienten normalisierten sich die LH-Spiegel (Abb. 2C) und die LH-Pulsamplitude nach der E2-Substitution.
-
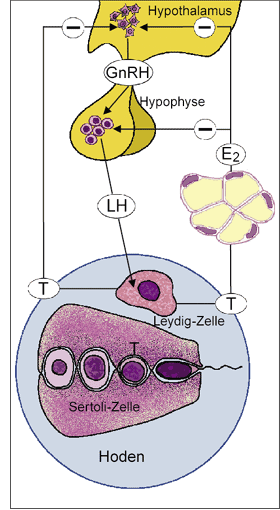
Testosteron und Estradiol haben jeweils unabhängige Auswirkungen auf die LH-Sekretion. Testosteron hat direkte hypothalamische Effekte und muss für Effekte
an der Hypophyse in Estradiol umgewandelt werden. Die negativen Feedback-Effekte des Estradiols auf die LH-Sekretion finden hauptsächlich im Hypothalamus statt.
|
Direkte hypothalamische Effekte des Testosterons offenbaren sich durch die Normalisierung der GnRH-Pulsfrequenz nach Testosteron-
Bei endokrinologisch normalen Männern findet Estradiol-Feedback auf der HHT-Achse in erster Linie im Hypothalamus statt. Denn wird der Estradiolspiegel
selektiv supprimiert, kommt es bei gesunden Männern zu einer deutlichen Erhöhung der GnRH-Pulsfrequenz. Das wird auch durch die gleichzeitige Erhöhung
des Testosteronspiegels nicht verhindert, obwohl der GnRH-Pulsgenerator normalerweise dadurch gebremst werden sollte. Seit längerem ist zudem bekannt,
dass die Gabe von Antiöstrogenen bei normalen Männern eine Erhöhung der LH-Pulsfrequenz bewirkt.
Ferner bestätigen die Ergebnisse dieser Studie frühere Befunde, wonach die Estradiol-Effekte am Hypothalamus im Wesentlichen über peripheres und
nicht zentral gebildetes Estradiol zustande kommen
Literatur:
Pitteloud N, Dwyer A, DeCruz S, et al. 2008.
Inhibition of luteinizing hormone secretion by testosterone in men requires aromatization for its pituitary but not its hypothalamic effects: evidence
from the tandem study of normal and gonadotropin-releasing hormone-deficient men. J Clin Endocrinol Metab 93:784-791.
© 2003-2024 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
